题目内容
人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品小Ca2+的浓度.
[配制酸性KMnO4标准溶液]如图是配制50mL酸性KMnO4标准溶液的过程示意图.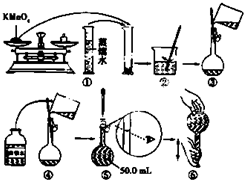
(1)请你观察图示判断其中不正确的操作有(填序号) .
(2)其中确定50mL溶液体积的容器是(填名称) .
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将 (填“偏大”或“偏小”).
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液.
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO
+5H2C2O4+6H+═2Mnx++10CO2↑+8H2O则式中的x= .
(5)滴定时,根据现象 ,即可确定反应达到终点.
(6)经过计算,血液样品中Ca2+的浓度为 mol/L.
[配制酸性KMnO4标准溶液]如图是配制50mL酸性KMnO4标准溶液的过程示意图.

(1)请你观察图示判断其中不正确的操作有(填序号)
(2)其中确定50mL溶液体积的容器是(填名称)
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液.
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO
- 4 |
(5)滴定时,根据现象
(6)经过计算,血液样品中Ca2+的浓度为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据图示分析配制一定物质的量浓度的溶液的操作正误;
(2)容量瓶是确定溶液体积的仪器;
(3)根据仰视刻度线,会使溶液体积偏大判断;
(4)根据电荷守恒进行分析;
(5)草酸具有还原性,能够使高锰酸钾褪色;
(6)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
(2)容量瓶是确定溶液体积的仪器;
(3)根据仰视刻度线,会使溶液体积偏大判断;
(4)根据电荷守恒进行分析;
(5)草酸具有还原性,能够使高锰酸钾褪色;
(6)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
解答:
解:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,
故答案为:②⑤;
(2)应该用容量瓶准确确定50mL溶液的体积,故答案为:容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,
故答案为:偏小;
(4)根据电荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2;
(5)草酸具有还原性,能够使高锰酸钾褪色,向无色草酸中加入酸性高锰酸钾,当草酸反应完后,滴加高锰酸钾显紫红色,且半分钟不退色,滴定到达终点;
故答案为:溶液由无色变为紫红色,且半分钟不退色;
(6)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,
根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=
n(MnO4-)=2.5×2.4×10-4mol=6
10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g,
钙离子的浓度为:
=1.2 mg/cm3,
故答案为:1.2.
故答案为:②⑤;
(2)应该用容量瓶准确确定50mL溶液的体积,故答案为:容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,
故答案为:偏小;
(4)根据电荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2;
(5)草酸具有还原性,能够使高锰酸钾褪色,向无色草酸中加入酸性高锰酸钾,当草酸反应完后,滴加高锰酸钾显紫红色,且半分钟不退色,滴定到达终点;
故答案为:溶液由无色变为紫红色,且半分钟不退色;
(6)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,
根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=
| 5 |
| 2 |
10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g,
钙离子的浓度为:
| 0.024g |
| 20cm3 |
故答案为:1.2.
点评:本题考查了配制一定物质的量浓度的方法及误差分析,题目难度不大,注意掌握配制一定浓度的溶液的方法及误差分析方法及技巧.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
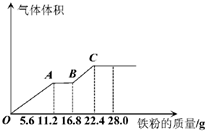 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析错误的是( )| A、AB段的反应为:Fe+2Fe3+=3Fe2+ |
| B、第二份溶液中最终溶质为FeSO4 |
| C、混合酸中NO3-物质的量为0.4mol |
| D、混合酸中H2SO4浓度为5mol?L-1 |
下列是有关实验操作的步骤和做法,不正确的是( )
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部 |
有A、B、C、D四个反应的焓变和熵变如表所示:下列说法正确的是( )
| 反应 | A | B | C | D |
| △H/kJ?mol-1 | 10.5 | 1.80 | -126 | -11.7 |
| △S/kJ?mol-1?k-1 | 30.0 | -113.0 | 84.0 | -105.0 |
| A、反应A在任何温度下均可自发进行 |
| B、反应B在任何温度下均不可自发进行 |
| C、反应C必须在温度高于170℃时才能自发进行 |
| D、反应D在任何温度下均不可自发进行 |
下列说法正确的是( )
| A、只含有一种元素的物质一定是单质 |
| B、胶体与溶液的本质区别在于是否有丁达尔现象 |
| C、一定温度、压强下,气体体积由其物质的量的多少决定 |
| D、向盛有沸水的烧杯中滴加FeCl3溶液并长时间煮沸,制备Fe(OH)3胶体 |