题目内容
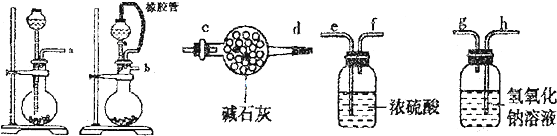
用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2
2SO3△H=-196.6kJ/mol.已知:
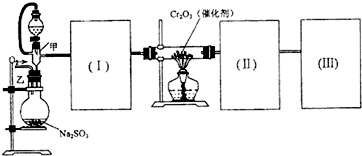
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内.
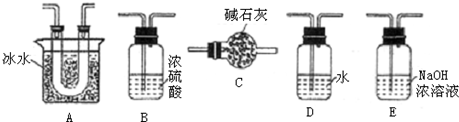
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) .
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是 .
(4)开始实验时,先从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 .
a 先加热催化剂再缓缓滴入浓硫酸 b 先滴入浓硫酸再缓缓加热催化剂
(5)实验中“当Cr2O3表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有Cr2O3处的反应管时,SO2的转化率会 (填“升高”、“降低”或“不变”).
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为 %(保留小数点后一位).
| Cr2O3 |
| 熔点(℃) | 沸点(℃) | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内.

(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是
(4)开始实验时,先从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是
a 先加热催化剂再缓缓滴入浓硫酸 b 先滴入浓硫酸再缓缓加热催化剂
(5)实验中“当Cr2O3表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为
考点:探究物质的组成或测量物质的含量
专题:实验设计题
分析:(1)二氧化硫的干燥用浓硫酸,当温度低于16.8℃可以获得三氧化硫的晶体,尾气处理用烧碱溶液;
(2)气体的制备及性质实验中需要检查装置的气密性;
(3)利用压强使液体顺利流下;
(4)为保证生成的二氧化硫尽可能的转化为三氧化硫,应先加热催化剂再进行滴加浓硫酸操作;
(5)反应为放热反应;
(6)利用Na2SO3~SO2~SO3关系式,进行计算.
(2)气体的制备及性质实验中需要检查装置的气密性;
(3)利用压强使液体顺利流下;
(4)为保证生成的二氧化硫尽可能的转化为三氧化硫,应先加热催化剂再进行滴加浓硫酸操作;
(5)反应为放热反应;
(6)利用Na2SO3~SO2~SO3关系式,进行计算.
解答:
解:(1)SO2转化成SO3之前必须对二氧化硫进行干燥,可以用浓硫酸,SO3的熔点是16.8℃,沸点是44.8℃,当温度低于 16.8℃时,三氧化硫以晶体状态存在,二氧化硫、三氧化硫的尾气处理用烧碱溶液吸收,
故答案为:B;A;E;
(2)实验前,必须进行的操作是检查装置的气密性,故答案为:检查装置的气密性;
(3)为使液体顺利流下,则甲装置所起的作用是保持分液漏斗内压强与烧瓶内压强相等,
故答案为:保持分液漏斗内压强与烧瓶内压强相等;
(4)为保证生成的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再进行滴加浓硫酸操作,保证生成的二氧化硫尽可能的参与反应,
故答案为:先加热催化剂,然后缓慢滴加浓硫酸;
(5)反应为放热反应,温度过高不利用二氧化硫的生成,降低二氧化硫的转化率,
故答案为:温度过高不利用二氧化硫的生成,降低二氧化硫的转化率,降低;
(6)由硫原子守恒可知,Na2SO3~SO2~SO3,n(Na2SO3)=
=0.2mol,则生成n(SO3)=0.2mol,其质量为0.2mol×80g/mol=16g,称得Ⅱ处装置的质量增加13.68g,则SO2的转化率为
×100%=85.5%,
故答案为:85.5%.
故答案为:B;A;E;
(2)实验前,必须进行的操作是检查装置的气密性,故答案为:检查装置的气密性;
(3)为使液体顺利流下,则甲装置所起的作用是保持分液漏斗内压强与烧瓶内压强相等,
故答案为:保持分液漏斗内压强与烧瓶内压强相等;
(4)为保证生成的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再进行滴加浓硫酸操作,保证生成的二氧化硫尽可能的参与反应,
故答案为:先加热催化剂,然后缓慢滴加浓硫酸;
(5)反应为放热反应,温度过高不利用二氧化硫的生成,降低二氧化硫的转化率,
故答案为:温度过高不利用二氧化硫的生成,降低二氧化硫的转化率,降低;
(6)由硫原子守恒可知,Na2SO3~SO2~SO3,n(Na2SO3)=
| 25.2g |
| 126g/mol |
| 13.68g |
| 16g/mol |
故答案为:85.5%.
点评:本题考查二氧化硫的性质、计算等等知识,综合性较强,题目难度较大.重点考查学生分析和解决问题的能力.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
下列说法正确的是( )
| A、化学键断裂的过程是吸收能量的过程 |
| B、水分解产生氢气和氧气时放出能量 |
| C、需要加热的反应就是吸热反应 |
| D、并不是所有的化学反应都伴随着能量变化 |
能正确表示下列反应的离子方程式是( )
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、过量的二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=HCO3-+Al(OH)3↓ |
| C、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
下列是有关实验操作的步骤和做法,不正确的是( )
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、实验室制取氧气完毕后,应先取出集气瓶,再取出导管,最后停止加热 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、用试管夹夹持试管时,把试管夹从试管底部往上套,夹在试管中上部 |
 将1.000g FeC2O4?2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:
将1.000g FeC2O4?2H2O固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示: