题目内容
14.某烧杯中盛有100mLHCl和CuCl2的混合液,混合溶液中c(HCl)=2mol/L,c(CuCl2)=1mol/L.请回答下列问题:①该混合溶液中,n(H+)=0.2mol;c(Cl-)=4mol/L.
向上述烧杯中加入足量铁粉并使之充分反应.写出有关的离子方程式:
②2H++Fe═Fe2++H2↑;Cu2++Fe═Cu+Fe2+.
分析 ①n=CV;根据Cl原子守恒得c(Cl-)=c(HCl)+2c(CuCl2);
②向该溶液中加入足量Fe粉,Fe和氢离子及铜离子发生置换反应.
解答 解:①根据H原子守恒得c(H+)=c(HCl)=2mol/L,n(H+)=CV=2mol/L×0.1L=0.2mol;根据Cl原子守恒得c(Cl-)=c(HCl)+2c(CuCl2)=2mol/L+1mol/L×2=4mol/L,
故答案为:0.2;4;
②向该溶液中加入足量Fe粉,Fe和氢离子及铜离子发生置换反应,分别生成氢气和Cu,离子方程式分别为2H++Fe═Fe2++H2↑、Cu2++Fe═Cu+Fe2+,
故答案为:2H++Fe═Fe2++H2↑;Cu2++Fe═Cu+Fe2+.
点评 本题考查物质的量浓度有关计算及离子方程式书写,为高频考点,侧重考查学生分析判断及计算能力,灵活运用原子守恒是解本题关键,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
5.为了节约煤炭和石油资源,用较少的碳原料生成较多的燃料提供给人类,一碳化学应运而生.合成气(CO、H2)、甲烷和甲醇是一碳化学的基础原料,表所列为25℃、101kPa时四种物质的燃烧热:
回答下列问题:
(1)25℃时,用合成气制备甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(l)△H=-128.1kJ?mol-1.
(2)工业上可利用甲烷制造合成气,发生的反应为CH4(g)+CO2(g)?2CO(g)+2H2(g);某温度下,向容积为4L的恒容密闭容器中通入6mol CO2和6mol CH4发生上述反应,5min后在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5min内的平均反应速率v(CO)=0.2mol?L-1?min-1;在相同温度下,将上述反应改在起始容积为4L的恒压密闭容器内进行,则到达平衡的时间大于(填“大于”或“小于”或“等于”)5min.
(3)反应CH3OH(g)+CO(g)?HCOOCH3(g)△H=-29.1kJ?mol-1为一碳化学在有机合成方面的重要应用.温度和压强对该反应的影响如图所示:

①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸(HCOOCH3)甲酯应选择的压强是b(填下列序号字母);
a.3.5×106Pa b.4.0×106 Pa c.5.0×106 Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低.
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |
(1)25℃时,用合成气制备甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(l)△H=-128.1kJ?mol-1.
(2)工业上可利用甲烷制造合成气,发生的反应为CH4(g)+CO2(g)?2CO(g)+2H2(g);某温度下,向容积为4L的恒容密闭容器中通入6mol CO2和6mol CH4发生上述反应,5min后在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5min内的平均反应速率v(CO)=0.2mol?L-1?min-1;在相同温度下,将上述反应改在起始容积为4L的恒压密闭容器内进行,则到达平衡的时间大于(填“大于”或“小于”或“等于”)5min.
(3)反应CH3OH(g)+CO(g)?HCOOCH3(g)△H=-29.1kJ?mol-1为一碳化学在有机合成方面的重要应用.温度和压强对该反应的影响如图所示:

①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸(HCOOCH3)甲酯应选择的压强是b(填下列序号字母);
a.3.5×106Pa b.4.0×106 Pa c.5.0×106 Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低.
9.CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H1.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃、500℃的密闭容器中,甲醇的物质的量;图2:温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数).下列叙述正确的是( )
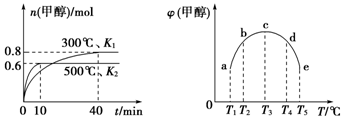

| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
3.化合物在水溶液中因存在以下电离平衡:HIn(红色)?H++In-(黄色),故可用作 酸碱指示剂.浓度为0.4mol/L的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤硝酸钾溶液 ⑥氨水,其中能使指示剂显红色的是( )
| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
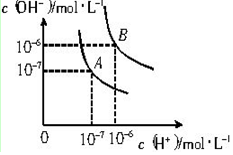
4.一定温度下,水存在H 2O?H++OH-△H=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量固体HCl气体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |