题目内容
2.可逆反应:2NO2(g)?2NO(g)+O2(g),在容积固定的密闭容器中,达到平衡状态的标志正确的有( )①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
⑧NO2的转化率不再随时间改变而改变
⑨NO与O2的物质的量之比不再随时间改变而改变
⑩n(NO2):n(NO):n(O2)=2:2:1
⑪化学平衡常数K不再随时间改变而改变.
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:①单位时间内生成n mol O2的同时生成2n mol NO2 同时消耗n mol O2,正逆反应速率相等,反应达到平衡状态,故正确;
②无论反应是否达到平衡状态都存在单位时间内生成n mol O2的同时生成2n mol NO,不能据此判断平衡状态,故错误;
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态,该反应不一定达到平衡状态,因为反应方向不明确,不能据此判断平衡状态,故错误;
④混合气体的颜色不再改变的状态,说明正逆反应速率相等,反应达到平衡状态,故正确;
⑤无论反应是否达到平衡状态,混合气体的密度始终保持不变,不能据此判断平衡状态,故错误;
⑥反应前后气体物质的量增大、压强增大,混合气体的压强不再改变的状态,各物质的物质的量不变,反应达到平衡状态,故正确;
⑦反应前后气体物质的量增大、气体质量不变,则混合气体的平均相对分子质量减小,当混合气体的相对分子质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
⑧NO2的转化率不再随时间改变而改变,说明二氧化氮的物质的量一定,反应达到平衡状态,故正确;
⑨NO与O2的物质的量之比不再随时间改变而改变时,该反应不一定达到平衡状态,故错误;
⑩n(NO2):n(NO):n(O2)=2:2:1,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,故错误;
⑪化学平衡常数K不再随时间改变而改变,如果该容器是绝热的就说明达到平衡状态,如果是恒温条件下的就不能说明达到平衡状态,故错误;
故选B.
点评 本题考查化学平衡状态的判断,为高频考点,侧重考查学生分析判断能力,只有反应前后改变的物理量才能作为平衡状态判断依据,关键是正确选取合适的判断依据,题目难度不大.

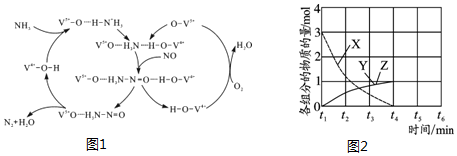
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO (g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N═O |
| 键能/kJ•mol-1 | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
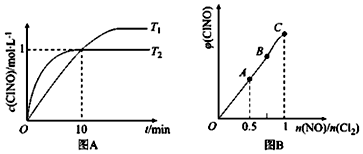
由图A可判断T1、T2温度的速率:v1<v2(“>”“<”或“=”),该反应的△H<0 (“>”“<”或“=”).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),发生反应2NO(g)+C12(g)?2C1NO(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点(“A、B、C”).
| A. | 都能使溶液的pH增大 | |
| B. | 都能使溶液中c(H+)•c(CH3COO-)减小 | |
| C. | 都能使溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大 | |
| D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变 |
| A. | 汽油的燃烧 | B. | 干冰的升华 | C. | 钢铁的锈蚀 | D. | 电解饱和食盐水 |
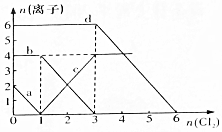 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答: