题目内容
19.下列有关实验操作或结果的说法中正确的是CE(填字母).A.滴定时,眼睛应始终注视滴定管内液面的变化
B.滴定实验都需要指示剂
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些.
分析 A.滴定时,眼睛应始终注视锥形瓶内液体颜色变化;
B.滴定实验不一定都需要指示剂;
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗,否则会导致测定值偏大;
D.用pH试纸测量某溶液的pH时不能先将试纸润湿,否则有偏差;
E.滴定管经蒸馏水洗净后,直接注入标准液,会导致标准液浓度偏低;
F.泛pH试纸测定值为整数;
G.滴定终点附近间隔要小些.
解答 解:A.酸碱中和滴定实验中,滴定时眼睛注视锥形瓶中溶液的颜色变化,以便及时判断滴定终点,不需要观察滴定管内液面的变化,故A错误;
B.KMnO4本身为紫红色,则用KMnO4滴定亚硫酸钠溶液的实验到达终点时,将出现红色,所以不需要另外加入指示剂,故B错误;
C.锥形瓶用蒸馏水洗净后,又用待测溶液润洗,增大待测液中的溶质的物质的量,消耗标准液体积增大,测定结果偏大,故C正确;
D.用pH试纸测量某溶液的pH时将试纸润湿,则溶液被稀释,影响测定结果,故D错误;
E.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定,标准液浓度降低,消耗标准液体积增大,测定结果偏大,故E正确;
F.泛pH试纸测定值为整数,所以读数不可能是小数,故F错误;
G.滴定终点附近间隔要小些,否则可能产生较大误差,故G错误;
故选CE.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断、实验操作及实验评价能力,明确实验原理、实验操作方法是解本题关键,易错选项是B.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
9.发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂.
(1)肼易溶于水,性质与氨相似,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H+5+OH-.
(2)肼(N2H4)与N2O4的反应为:2N2H4 (1)+N2O4 (1)=3N2(g)+4H2O(1)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如下:
则使1mol N2O4 (1)分子中化学键完全断裂时需要吸收的能量是1793kJ
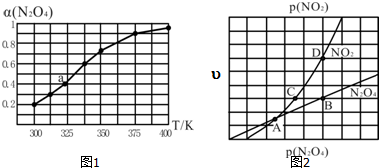
(3)N2O4与NO2之间存在反应N2O4(g)═2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),理由为温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应,△H>0,若要提高N2O4的转化率,除改变反应温度外,其他措施有减小体系压强(或移出NO2等)(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:υ(N2O4)=k1p(N2O4),υ(NO2)=k2p2(NO2),其中kl、k2是与反应温度有关的常数.相应的速率一压强关系如图2所示,一定温度下,kl、k2与平衡常数Kp的关系是kl=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点,理由是满足平衡条件υ(NO2)=2υ(N2O4).

(1)肼易溶于水,性质与氨相似,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H+5+OH-.
(2)肼(N2H4)与N2O4的反应为:2N2H4 (1)+N2O4 (1)=3N2(g)+4H2O(1)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如下:
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
(3)N2O4与NO2之间存在反应N2O4(g)═2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),理由为温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应,△H>0,若要提高N2O4的转化率,除改变反应温度外,其他措施有减小体系压强(或移出NO2等)(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:υ(N2O4)=k1p(N2O4),υ(NO2)=k2p2(NO2),其中kl、k2是与反应温度有关的常数.相应的速率一压强关系如图2所示,一定温度下,kl、k2与平衡常数Kp的关系是kl=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点,理由是满足平衡条件υ(NO2)=2υ(N2O4).
7.向0.1mol•L-1的CH3COOH溶液中加水或加入少量CH3COONa晶体时,下列有关叙述不正确的是( )
| A. | 都能使溶液的pH增大 | |
| B. | 都能使溶液中c(H+)•c(CH3COO-)减小 | |
| C. | 都能使溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大 | |
| D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变 |
9.某化学反应的△H=+120KJ/mol,△S=+100J/(mol•k),则该反应能自发进行的是( )
| A. | 仅在高温下 | B. | 在任何温度下都不能自发进行 | ||
| C. | 在任何温度下 | D. | 仅在低温下 |
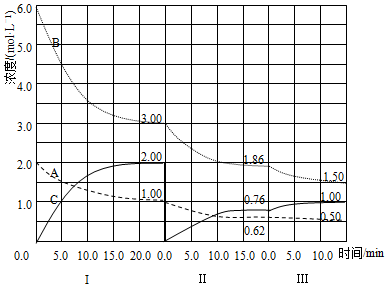
 工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.
工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.