题目内容
3.化合物在水溶液中因存在以下电离平衡:HIn(红色)?H++In-(黄色),故可用作 酸碱指示剂.浓度为0.4mol/L的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤硝酸钾溶液 ⑥氨水,其中能使指示剂显红色的是( )| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
分析 能使指示剂显红色,应使c(HIn)>c(In-),所加入物质应使平衡向逆反应方向移动,所加入溶液应呈酸性,以此解答该题.
解答 解:能使指示剂显红色,应使c(HIn)>c(In-),所加入物质应使平衡向逆反应方向移动,所加入溶液应呈酸性,
①④为酸性溶液,可使平衡向逆反应方向移动,溶液变红色;
②⑥溶液呈碱性,可使平衡向正反应方向移动;
③⑤为中性溶液,平衡不移动;
所以能使指示剂显红色的是①④;
故选A.
点评 本题考查化学平衡的影响因素,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意根据颜色的变化判断平衡移动的移动方向,结合外界条件对平衡移动的影响分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.一般检验SO42-的试剂是( )
| A. | BaCl2、稀硝酸 | B. | AgNO3、稀硝酸 | C. | 稀盐酸、BaCl2 | D. | AgNO3、稀盐酸 |
15.NO2被誉为生命的“信息分子”,在100℃时,将0.100mol的无色N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到表数据:
从表中分析:该温度下,达平衡时N2O4的转化率=60%;反应N2O4(g)?2NO2(g)的平衡常数=0.36;升高温度,容器中气体的颜色变深,则反应2NO2(g)?N2O4(g)的△H<0(填:>、<、=);在上述条件下,60s内N2O4的平均反应速率=0.001mol•L-1•s-1.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
12.下列过程中属于物理变化的是( )
| A. | 汽油的燃烧 | B. | 干冰的升华 | C. | 钢铁的锈蚀 | D. | 电解饱和食盐水 |
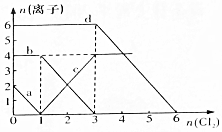 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
 工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.
工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.