题目内容
5.为了节约煤炭和石油资源,用较少的碳原料生成较多的燃料提供给人类,一碳化学应运而生.合成气(CO、H2)、甲烷和甲醇是一碳化学的基础原料,表所列为25℃、101kPa时四种物质的燃烧热:| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |
(1)25℃时,用合成气制备甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(l)△H=-128.1kJ?mol-1.
(2)工业上可利用甲烷制造合成气,发生的反应为CH4(g)+CO2(g)?2CO(g)+2H2(g);某温度下,向容积为4L的恒容密闭容器中通入6mol CO2和6mol CH4发生上述反应,5min后在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5min内的平均反应速率v(CO)=0.2mol?L-1?min-1;在相同温度下,将上述反应改在起始容积为4L的恒压密闭容器内进行,则到达平衡的时间大于(填“大于”或“小于”或“等于”)5min.
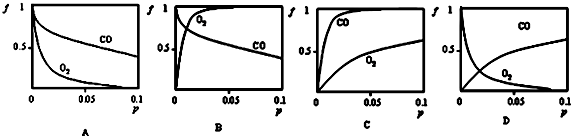
(3)反应CH3OH(g)+CO(g)?HCOOCH3(g)△H=-29.1kJ?mol-1为一碳化学在有机合成方面的重要应用.温度和压强对该反应的影响如图所示:

①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸(HCOOCH3)甲酯应选择的压强是b(填下列序号字母);
a.3.5×106Pa b.4.0×106 Pa c.5.0×106 Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低.
分析 (1)CO燃烧的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 ①
H2燃烧的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 ②
甲醇的燃烧热为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5kJ/mol③
将方程式①+2②-③得CO(g)+2H2(g)?CH3OH(l),焓变进行相应的改变;
(2)某温度下,向容积为4L的恒容密闭容器中通入6mol CO2和6mol CH4发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),5min后在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,说明四种气体的物质的量相等,设参加反应的n(CO2)=xmol,
该反应CH4(g)+CO2(g)?2CO(g)+2H2(g)
开始(mol)6 6 0 0
反应(mol)x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
因为各气体物质的量相等,则6-x=2x,x=2,
达到平衡状态时生成n(CO)=2x=4mol,该反应在0~5min内的平均反应速率v(CO)=$\frac{\frac{△n}{V}}{△t}$;在相同温度下,将上述反应改在起始容积为4L的恒压密闭容器内进行,该反应前后气体物质的量增大,则压强增大,则恒压条件下压强小于恒容条件下压强,压强越大反应速率越大;
(3)①增大压强甲醇转化率增大,但压强越大对设备要求越大;
②反应速率随温度升高而增大,升高温度平衡逆向移动.
解答 解:(1)CO燃烧的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 ①
H2燃烧的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 ②
甲醇的燃烧热为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5kJ/mol ③
将方程式①+2②-③得CO(g)+2H2(g)?CH3OH(l),△H=(-283.0 kJ•mol-)+2(-285.8 kJ•mol-1)-(-726.5kJ/mol)=-128.1kJ?mol-1,
故答案为:CO(g)+2H2(g)?CH3OH(l)△H=-128.1kJ?mol-1;
(2)某温度下,向容积为4L的恒容密闭容器中通入6mol CO2和6mol CH4发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),5min后在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,说明四种气体的物质的量相等,设参加反应的n(CO2)=xmol,
该反应CH4(g)+CO2(g)?2CO(g)+2H2(g)
开始(mol)6 6 0 0
反应(mol)x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
因为各气体物质的量相等,则6-x=2x,x=2,
达到平衡状态时生成n(CO)=2x=4mol,该反应在0~5min内的平均反应速率v(CO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{4mol}{4L}}{5min}$=0.2mol?L-1?min-1;在相同温度下,将上述反应改在起始容积为4L的恒压密闭容器内进行,该反应前后气体物质的量增大,则压强增大,则恒压条件下压强小于恒容条件下压强,压强越大反应速率越大,则到达平衡的时间大于5min;
故答案为:0.2mol?L-1?min-1;大于;
(3)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率较大的是4.0×106Pa,故选:b;
②依据图象分析,温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,所以实际工业生产中采用的温度是80℃,
故答案为:温度高于80℃,升温对反应速率影响较小,且该反应放热,升高温度平衡逆向移动,转化率降低.
点评 本题考查化学平衡计算、盖斯定律、外界条件对化学平衡移动影响等知识点,为高频考点,侧重考查学生计算、分析判断能力,明确温度、压强对化学平衡移动影响原理是解本题关键,注意结合实际生产分析解答,题目难度不大.

| A. | NaOH[H2O] | B. | CuCl2[CuSO4] | C. | NaCl[NaCl] | D. | CuSO4[Cu(OH)2] |
| A. | Cu | B. | Fe | C. | Al | D. | Mg |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |

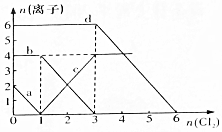 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答: