题目内容
4.氮元素的化合态与游离态在一定的条件下可相互转化,从而实现了自然界中的氮循环.(1)已知有关热化学方程式如下:
①4NH3(g)+5O2 (g)?4NO(g)+6H2O(g)△H=-905KJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
④N2 (g)+O2 (g)═2NO (g)△H=QKJ/mol
反应①中有关化学键的键能(kJ/mol)如下:H-O键:463,H-N键:391,O=O键;497.则NO中的化学键键能为631.5kJ/mol,Q=+180.5.
(2)向某恒容器密闭容器中充入2.4molNH3,3.1molO2发生反应:4NH3(g)+5O2 (g)?4NO(g)+6H2O(g)△H=-905KJ/mol;测得平衡时反应体系中某种量值X与压强p、温度T之间的变化如图Ⅰ所示.

①X表示NH3的百分含量,则p2>p1(填“>”或“<”);b、c两点对应的平衡常数K(b)=K(c)(填“>”、“<”或“=”).
②X还可以表示a(填字母).
a.混合气体的平均摩尔质量 b.NO的产率 c.△H
(3)一定温度下,向2L某恒容器密闭容器中充入1.6molNH3,3.3molO2,测得NO、某种物质a的浓度与时间的关系如图Ⅱ所示.
①a物质是NH3,前3min内H2O表示的平均反应熟虑为v(H2O)=0.20mol/(L•min)
②该温度下的平衡常数K=73.9.
分析 (1)根据反应热=反应物的总键能-生成物的总键能计算;根据盖斯定律计算Q;
(2)①根据压强对化学平衡的影响分析;化学平衡常数与温度相关,温度不变,化学平衡常数K不变;
②由图要求压强越大,X的值越大,结合影响化学平衡的因素分析;
(3)①a物质的浓度减少,说明a为反应物,根据参与反应物质的反应比例与化学计量数之比可知a为氨气;反应速率由$\frac{△c}{△t}$计算;
②根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比计算.
解答 解:(1)设NO中的化学键键能为x,反应①4NH3(g)+5O2 (g)?4NO(g)+6H2O(g)△H=12×391+5×497-4x-12×463=-905,解得x=631.5;
已知:①4NH3(g)+5O2 (g)?4NO(g)+6H2O(g)△H=-905KJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
根据盖斯定律(①+2×②-3×③)÷2可得④N2 (g)+O2 (g)═2NO (g)△H=+180.5KJ/mol;
故答案为:631.5;+180.5;
(2)①反应4NH3(g)+5O2 (g)?4NO(g)+6H2O是个气体体积增大的反应,增大压强,化学平衡逆向移动,NH3的百分含量增大,由图可知p2的氨气百分含量大故p2>p1;b、c两点对应的温度不变,故平衡常数K(b)=K(c);
故答案为:>;=;
②对该反应,压强增大,反应逆向移动,a.混合气体的质量不变,逆向移动气体总物质的量变小,根据$\overline{M}=\frac{m}{n}$平均摩尔质量增大,正确;b.反应逆向移动,NO的产率减小,错误;c.具体反应4NH3(g)+5O2 (g)?4NO(g)+6H2O的△H不变,错误;
故答案为:a;
(3)①a物质的浓度减少,说明a为反应物,由图可知,前10min,△c(NO):△c(a)=0.6:0.6=1:1,
则a为氨气;前3min氨生成NO0.4mol/L,则生成的H2O为0.6mol/L,则前3min内H2O表示的平均反应速率为v(H2O)=$\frac{0.6mol/L}{3min}$=0.20mol/(L•min);
故答案为:NH3; 0.20mol/(L•min);
②由图可知反应在10min平衡,向2L某恒容器密闭容器中充入1.6molNH3,3.3molO2,
4NH3(g)+5O2 (g)?4NO(g)+6H2O
c始:0.8 1.65 0 0
c转:0.6 0.75 0.6 0.9
c平:0.2 0.9 0.6 0.9
则K=$\frac{0.{9}^{6}×0.{6}^{4}}{0.{2}^{4}×0.{9}^{5}}$=72.9;
故答案为:72.9.
点评 本题考查了盖斯定律、反应热与键能的关系、影响化学平衡的因素以及有关化学平衡的计算,注重对学生基础的考查,题目难度不大,注意反应热的符号单位.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | NaOH[H2O] | B. | CuCl2[CuSO4] | C. | NaCl[NaCl] | D. | CuSO4[Cu(OH)2] |
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO (g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N═O |
| 键能/kJ•mol-1 | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
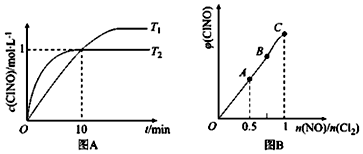
由图A可判断T1、T2温度的速率:v1<v2(“>”“<”或“=”),该反应的△H<0 (“>”“<”或“=”).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),发生反应2NO(g)+C12(g)?2C1NO(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点(“A、B、C”).
| A. | 用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液 | |
| B. | Fe(OH)3胶体的胶粒带正电荷,通电时胶粒向直流电源的负极移动,这种现象称为电泳 | |
| C. | 向沸腾蒸馏水逐滴加饱和FeCl3溶液,至液体呈透明红褐色时即得到Fe(OH)3胶体 | |
| D. | 向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅动,然后继续煮沸,制备Fe(OH)3胶体 |
(1)肼易溶于水,性质与氨相似,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H+5+OH-.
(2)肼(N2H4)与N2O4的反应为:2N2H4 (1)+N2O4 (1)=3N2(g)+4H2O(1)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如下:
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
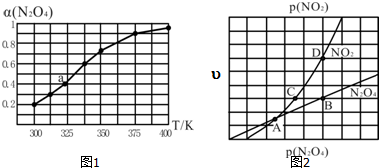
(3)N2O4与NO2之间存在反应N2O4(g)═2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),理由为温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应,△H>0,若要提高N2O4的转化率,除改变反应温度外,其他措施有减小体系压强(或移出NO2等)(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:υ(N2O4)=k1p(N2O4),υ(NO2)=k2p2(NO2),其中kl、k2是与反应温度有关的常数.相应的速率一压强关系如图2所示,一定温度下,kl、k2与平衡常数Kp的关系是kl=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点,理由是满足平衡条件υ(NO2)=2υ(N2O4).

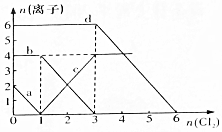 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答: