题目内容
4.一定温度下,水存在H 2O?H++OH-△H=Q(Q>0)的平衡,下列叙述一定正确的是( )| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量固体HCl气体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
分析 根据水的电离方程式知,向水中加入酸或碱抑制水电离,加入含有弱根离子的盐能促进水电离,水的离子积常数只与温度有关,水的电离过程为吸热过程,加热促进水的电离,以此解答该题.
解答 解:A.温度不变,水的离子积常数不变,与溶液的酸碱性无关,向水中滴入少量稀盐酸,平衡逆向移动,Kw减变,故A错误;
B.水的电离是吸热反应,升高温度促进水电离,离子积常数Kw增大,氢离子浓度增大,溶液的pH减小,故B错误;
C.向水中加入少量固体HCl气体,平衡逆向移动,但c(H+)增大,故C错误;
D.温度不变水的离子积常数不变,硫酸钠是强酸强碱盐,向水中加入硫酸钠固体后,不影响平衡移动,溶液中氢离子浓度等于氢氧根离子浓度,温度不知,氢离子浓度不变,故D正确;
故选D.
点评 本题考查离子积常数、水的电离,为高频考点,明确氢离子或氢氧根离子抑制水电离、弱离子促进水电离即可解答,注意离子积常数与溶液酸碱性无关,只与温度有关,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.NO2被誉为生命的“信息分子”,在100℃时,将0.100mol的无色N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到表数据:
从表中分析:该温度下,达平衡时N2O4的转化率=60%;反应N2O4(g)?2NO2(g)的平衡常数=0.36;升高温度,容器中气体的颜色变深,则反应2NO2(g)?N2O4(g)的△H<0(填:>、<、=);在上述条件下,60s内N2O4的平均反应速率=0.001mol•L-1•s-1.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
12.下列过程中属于物理变化的是( )
| A. | 汽油的燃烧 | B. | 干冰的升华 | C. | 钢铁的锈蚀 | D. | 电解饱和食盐水 |
19.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| C. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
9.某化学反应的△H=+120KJ/mol,△S=+100J/(mol•k),则该反应能自发进行的是( )
| A. | 仅在高温下 | B. | 在任何温度下都不能自发进行 | ||
| C. | 在任何温度下 | D. | 仅在低温下 |
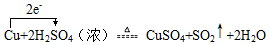 .实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
.实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.