题目内容
19.往120ml浓硫酸中加入一定量的Cu,加热使Cu完全溶解,将反应后的混合溶液用水稀释到500ml后加入足量Zn,生成无色无味气体4.48L(标况),将混合液中的残余固体过滤干燥后,发现比反应前加入的Zn质量少了14g.求:(1)与浓硫酸反应的Cu的质量.
(2)浓硫酸的物质的量浓度.
分析 根据反应方程式,判断反应的类型,根据气体的体积和固体质量的变化计算参加反应的铜和锌以及硫酸的物质的量,注意利用质量守恒定律.
解答 解:(1)设加入Cu片的量为xmol,n(H2)=$\frac{4.48L}{22.4L}$=0.2mol,
Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,
xmol 2xmol xmol
CuSO4+Zn═ZnSO4+Cu
xmol xmol xmol
Zn+H2SO4═ZnSO4+H2↑
0.2mol 0.2mol 0.2mol
由Zn溶解,产生Cu质量减轻14g可得:65g/mol×(xmol+0.2mol)-64g/mol×xmol=14g
∴x=1,
∴m(Cu)=1mol×64g/mol=64g
答:与浓硫酸反应的Cu的质量为64g
(2)原 H2SO4的物质的量浓度 c(H2SO4)=$\frac{n}{v}$=$\frac{2×1+0.2}{0.12}$=18.3mol/L,
答:原硫酸的物质的量浓度为18.3mol/L
点评 本题考查化学方程式的计算,题目难度中等,注意有关反应方程式的书写,以及题中数据的处理.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
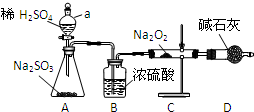
9. 某同学在奥运五连环中填入5种物质 (如图所示),相连环的物质间发生的反应中,没有涉及的基本反应类型是( )
某同学在奥运五连环中填入5种物质 (如图所示),相连环的物质间发生的反应中,没有涉及的基本反应类型是( )
 某同学在奥运五连环中填入5种物质 (如图所示),相连环的物质间发生的反应中,没有涉及的基本反应类型是( )
某同学在奥运五连环中填入5种物质 (如图所示),相连环的物质间发生的反应中,没有涉及的基本反应类型是( )| A. | 分解反应 | B. | 复分解反应 | C. | 化合反应 | D. | 置换反应 |
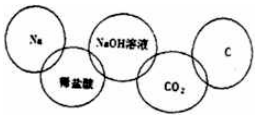
14. 硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
 硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )| A. | 负极反应式为4VB2+44OH-═2V2O5+4B2O3+22H2O | |
| B. | 正极反应式为11O2+44e-+22H2O=44OH- | |
| C. | OH-由负极透过性选择性透过膜向正极迁移 | |
| D. | 电子由硼化钒电极负载流向电极a |
4.关于几种分子中的化学键描述不正确的是( )
| A. | 苯每个碳原子的未参加杂化的 2p 轨道形成大π键 | |
| B. | CH4中的 4 个 C-H 键都是 H 的 1s 轨道与 C 的 2p 轨道形成的 s-pσ键 | |
| C. | C2H4 中,每个碳原子的 sp2 杂化轨道形成σ键、未杂化的2p 轨道形成π键 | |
| D. | 乙炔分子中,每个碳原子都有两个未杂化的 2p 轨道形成π键 |
11.化学与生产、生活、社会密切相关.下列说法正确的是( )
| A. | 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用 | |
| B. | PM2.5颗粒分散到空气中可产生丁达尔效应 | |
| C. | 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧 | |
| D. | 淀粉、油脂、纤维素和蛋白质都是高分子化合物 |
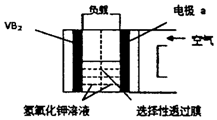
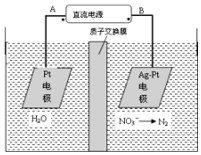 电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.
电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.