题目内容
2.某学习小组通过图实验装置,探究SO2与Na2O2反应的产物.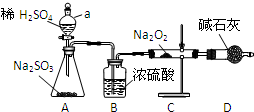
(1)A中反应的化学反应方程式为H2SO4+Na2SO3=Na2SO4+H2O+SO2↑,仪器a的名称是分液漏斗,B中浓硫酸的作用是干燥SO2.
(2)对C中固体产物的组成,甲同学提出如下假设:
假设1:只有Na2SO3假设2:只有Na2SO4 假设3:有Na2SO3和Na2SO4.
①若假设2成立,写出所发生反应的化学方程式Na2O2+SO2=Na2SO4.
②若Na2O2反应完全,为确定C中固体产物的成分,乙同学设计如下实验:

得出结论:产物是Na2SO4.请你分析该方案和结论是否合理?答:否(填“是”或“否”).理由是硝酸有强氧化性会将亚硫酸钡氧化成硫酸钡.
分析 (1)A中反应为浓硫酸和亚硫酸钠反应生成二氧化硫气体,仪器a为添加溶液的分液漏斗,B中浓硫酸具有吸水性;
(2)根据二氧化硫的还原性和过氧化钠的氧化性分析,强氧化性的物质和强还原性的物质发生氧化还原反应,写出相应的方程式;
硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子.
解答 解:(1)A中反应为浓硫酸和亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为:H2SO4+Na2SO3=Na2SO4+H2O+SO2↑,仪器a为添加溶液的分液漏斗,B中浓硫酸具有吸水性,干燥生成的二氧化硫气体,
故答案为:H2SO4+Na2SO3=Na2SO4+H2O+SO2↑; 分液漏斗;干燥SO2;
(2)假设1:只有Na2SO3; 假设2:只有Na2SO4;所以假设3为有Na2SO3和Na2SO4,
故答案为:有Na2SO3和Na2SO4;
①二氧化硫有还原性,过氧化钠有强氧化性,所以二氧化硫能被过氧化钠氧化,二氧化硫和过氧化钠反应的方程式为:Na2O2+SO2=Na2SO4 ,
故答案为:Na2O2+SO2=Na2SO4;
②硝酸有强氧化性会将亚硫酸钡氧化成硫酸钡,所以该方案不合理,故答案为:否;硝酸有强氧化性会将亚硫酸钡氧化成硫酸钡.
点评 本题考查了二氧化硫性质的实验,题目难度中等,会设计探究实验,根据实验现象得出正确结论,掌握基础是解题关键.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
18.下列分离或提纯物质的方法中,正确的是( )
| A. | 除去KC1中的K2CO3,可先加入过量的BaCl2溶液,待沉淀完全后再过滤、洗涤,取滤液蒸发即可 | |
| B. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| C. | 用冷却结晶的方法提纯含有少量KC1的KNO3 | |
| D. | 通过点燃可除去CO2中混有的CO气体 |
3.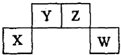 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )| A. | 常温下X的单质投入浓硫酸中没有明显现象 | |
| B. | Y的氢化物只有一种 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物排放不会造成环境污染 |
7.下表是元素周期表的一部分,针对表中的①~⑨中元素,按要求用相应的化学用语填空回答.
(1)①为铍(填元素名称),在这些元素中,非金属性最强的元素Ar(填元素符号),化学性质最不活泼的原子的原子结构示意图为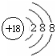 .
.
(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(离子符号表示)
(3)④⑦元素形成的化合物的电子式为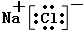
(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑦⑨两元素最高价氧化物对应水化物酸性H3PO4<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑨ | ⑦ | ⑧ |
 .
.(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(离子符号表示)
(3)④⑦元素形成的化合物的电子式为
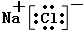
(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑦⑨两元素最高价氧化物对应水化物酸性H3PO4<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
14.已知热的氢氧化钾溶液与Cl2可发生如下反应:6KOH+3Cl2═5KCl+KClO3+3H2O则下列说法中正确的是( )
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
11.下列各组离子能够在指定的环境下大量共存的是( )
| A. | 在pH=0的溶液中:Na+、K+、MnO4-、I- | |
| B. | 中性溶液中:K+、SO42-、Fe3+、Na+ | |
| C. | c(H+)/c(OH-)=10-3的溶液中:Na+、K+、CO32-、S2- | |
| D. | 水电离出的H+为10-12溶液:K+、NH4+、Cl-、HCO3- |
12.同温同压下,某容器充满氧气时重116g,若充满CO2时重122g.现充满X气体时重114g,则X气体不可能是( )
| A. | CO | B. | N2 | C. | C2H4 | D. | HCl |
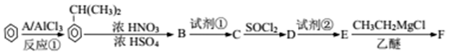
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
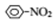 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$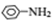 苯胺:弱碱性,易氧化
苯胺:弱碱性,易氧化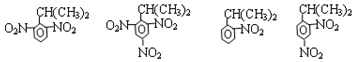 (写出一种的结构简式).
(写出一种的结构简式). .
.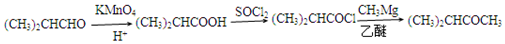 .
.