题目内容
4.关于几种分子中的化学键描述不正确的是( )| A. | 苯每个碳原子的未参加杂化的 2p 轨道形成大π键 | |
| B. | CH4中的 4 个 C-H 键都是 H 的 1s 轨道与 C 的 2p 轨道形成的 s-pσ键 | |
| C. | C2H4 中,每个碳原子的 sp2 杂化轨道形成σ键、未杂化的2p 轨道形成π键 | |
| D. | 乙炔分子中,每个碳原子都有两个未杂化的 2p 轨道形成π键 |
分析 A.苯中存在6中心6电子大π键;
B.CH4中C原子采取sp3杂化;
C.乙烯为平面结构,C原子采取sp2杂化,C=C中一个σ键,一个π键;
D.碳碳三键中含有一个σ键和两个π键,每个碳原子含有2个σ键且不含孤电子对,每个碳原子都有两个未杂化的2p轨道肩并肩重叠形成两个π键;
解答 解:A.苯中的C、C之间的化学键相同,每个碳原子的未参加杂化的2p轨道形成6中心6电子大π键,故A正确;
B.CH4中C原子采取sp3杂化,所以4个C-H键都是H的1s轨道与C的sp3轨道形成的s-sp3σ键,故B错误;
C.乙烯为平面结构,C原子采取sp2杂化,C=C中一个σ键,一个π键,即个碳原子的sp2杂化轨道形成σ键、未杂化的2p轨道形成π键,故C正确;
D.乙炔分子的结构式H-C≡C-H,中心原子碳原子价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$×(4-2×2)=2,采取sp杂化,每个碳原子都有两个未杂化的2p轨道形成π键,故D正确;
故选B.
点评 本题考查共价键的形成及原子的杂化轨道,明确原子的最外层电子及σ键、π键的形成原因是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
14.下列离子方程式的书写及评价,均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8H+=Fe2++2Fe3++4H2O | 正确,Fe2+与Fe3+物质的量之比为1:2 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应Ba2++HCO3 -+OH-═BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| A. | A | B. | B | C. | C | D. | D |
12.一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)?Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )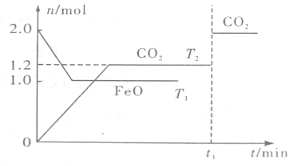

| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,T1>T2 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
9.X、Y、W、Z为四种短周期主族元素,在周期表中的位置如图所示.W原子的最外层电子数与电子层数相同,下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X只能形成一种氢化物 | |
| B. | W、X、Y的原子半径依次增大 | |
| C. | X的简单氢化物的热稳定性比Y的小 | |
| D. | W的最高价氧化物对应的水化物能溶于稀氨水 |
7.下表是元素周期表的一部分,针对表中的①~⑨中元素,按要求用相应的化学用语填空回答.
(1)①为铍(填元素名称),在这些元素中,非金属性最强的元素Ar(填元素符号),化学性质最不活泼的原子的原子结构示意图为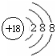 .
.
(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(离子符号表示)
(3)④⑦元素形成的化合物的电子式为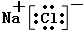
(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑦⑨两元素最高价氧化物对应水化物酸性H3PO4<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑨ | ⑦ | ⑧ |
 .
.(2)③⑤⑦元素形成的简单离子,离子半径由小到大的顺序Al3+<F-<Cl-(离子符号表示)
(3)④⑦元素形成的化合物的电子式为
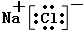
(4)用化学式,“<”或“>”比较,②③两元素气态氢化物的稳定性NH3<HF;⑦⑨两元素最高价氧化物对应水化物酸性H3PO4<HClO4.
(5)④⑤两元素最高价氧化物对应水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
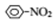 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$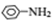 苯胺:弱碱性,易氧化
苯胺:弱碱性,易氧化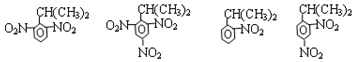 (写出一种的结构简式).
(写出一种的结构简式). .
.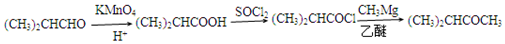 .
.