题目内容
10.实验室拟用浓盐酸与二氧化锰反应制取纯净的氯气.并验证氯气的性质.(Ⅰ)制取氯气:
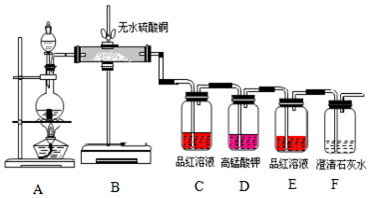
(1)如图1,按气体从左到右流动的方向将下列装置进行连接(填字母>,H→B、A→C.广口瓶Ⅱ中的试剂为饱和食盐水.
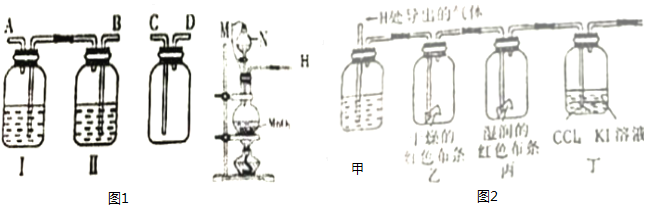
(2)仪器N的名称是分液漏斗;M是连通上下玻璃仪器的橡胶管,其目的是保证盐酸能顺利滴下;写出圆底烧瓶中发生反应的离子方程式MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2+2H2O.
(3)连接好仪器后,上述装置存在一个明显的缺陷,你的改进方法是在导管D处连接盛有氢氧化钠的烧杯.
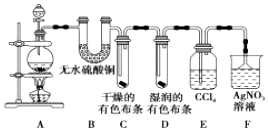
(Ⅱ)验证氯气的性质:将从上述发生装置H处导出的气体依次经过下图2装置验证氯气的性质(其他相关装置已略去)
(4)丁中出现的现象是下层溶液为紫红色,该反应证明了氯气的氧化性.
(5)证明HClO具有漂白性的实验现象是乙中布条不褪色,丙中布条褪色,甲中的试剂是浓硫酸.
分析 (1)实验装置的连接顺序为:发生装置、除杂装置、收集装置、尾气处理装置,依据收集气体密度选择进口与出口,依据氯气、氯化氢在饱和食盐水中溶解度选择除杂试剂;
(2)依据仪器的形状说出其名称;M是连通上下玻璃仪器的橡胶管,能够平衡分液漏斗与烧瓶压强,保证盐酸能顺利滴下;二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(3)氯气有毒,直接排放能够引起空气污染,需要进行尾气处理,依据氯气能够与氢氧化钠溶液反应,设计尾气处理装置;
(4)依据氯气能够与碘化钾反应生成单质碘结合氧化剂氧化性大于氧化产物氧化性解答;
(5)依据乙中干燥布条不褪色,说明干燥氯气不具有漂白性,丙中湿润布条褪色,说明氯气与水反应生成的次氯酸具有漂白性解答.
解答 解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,段导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气,正确的顺序为:H→B、A→C;
广口瓶Ⅱ中的试剂为饱和食盐水,作用除去氯气中的氯化氢;
故答案为:B、A、C;饱和食盐水;
(2)依据仪器的形状可知N为分液漏斗;M是连通上下玻璃仪器的橡胶管,能够平衡分液漏斗与烧瓶压强,保证盐酸能顺利滴下;二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2+2H2O;
(3)氯气有毒,能与氢氧化钠反应,含有氯气的尾气应选择氢氧化钠溶液吸收,防止污染空气,具体改进方法为:在导管D处连接盛有氢氧化钠的烧杯;
故答案为:在导管D处连接盛有氢氧化钠的烧杯;
(4)装置丁中氯气与碘化钾反应生成单质碘,此反应体现氯气的氧化性,生成的碘易溶于四氯化碳,四氯化碳密度大于水,不溶于水,所以看到现象为:下层溶液为紫红色;
故答案为:下层溶液为紫红色;氧化;
(5)乙中干燥布条不褪色,说明干燥氯气不具有漂白性,丙中湿润布条褪色,说明氯气与水反应生成的次氯酸具有漂白性,装置甲中为浓硫酸,作用干燥氯气;
故答案为:乙中布条不褪色,丙中布条褪色;浓硫酸.
点评 本题考查了实验室制备氯气的方法和原理分析,氯气性质的分析应用,明确反应原理及氯气的性质是解题关键,题目难度不大.

| A. | 除去KC1中的K2CO3,可先加入过量的BaCl2溶液,待沉淀完全后再过滤、洗涤,取滤液蒸发即可 | |
| B. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| C. | 用冷却结晶的方法提纯含有少量KC1的KNO3 | |
| D. | 通过点燃可除去CO2中混有的CO气体 |
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热;;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
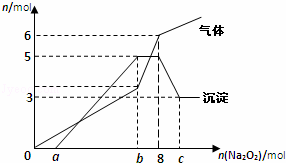 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )| A. | 2mol、3mol、6mol | B. | 3mol、2mol、6mol | C. | 2mol、3mol、4mol | D. | 3mol、2mol、2mol |
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
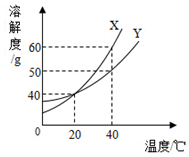 X、Y两种固体的溶解度曲线见图.
X、Y两种固体的溶解度曲线见图.