题目内容
在容积为2.0L的密闭容器中充入0.60mol X和1.60mol Y,发生反应:aX(g)+3Y(g)?2Z(g)
经过10min反应达到平衡状态,X的物质的量为0.2mol,Y的浓度为0.2mol/L.计算并回答:
(1)a 的值
(2)该条件下X的平衡转化率为 (保留一位小数)
(3)该条件下反应2Z(g)?aX(g)+3Y(g)的平衡常数为
(4)达平衡后,若再充入1molX,则平衡 (填“向左”、“向右”或“不”)移动
X的转化率会 (填“增大”、“减少”或“不变”)
经过10min反应达到平衡状态,X的物质的量为0.2mol,Y的浓度为0.2mol/L.计算并回答:
(1)a 的值
(2)该条件下X的平衡转化率为
(3)该条件下反应2Z(g)?aX(g)+3Y(g)的平衡常数为
(4)达平衡后,若再充入1molX,则平衡
X的转化率会
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据物质的量的变化量之比等于计量数之比,计算a;
(2)根据转化率=
×100%;
(3)根据平衡常数的定义计算平衡常数的值;
(4)根据改变反应物浓度,对平衡移动的影响判断;
(2)根据转化率=
| 已转化的物质的量 |
| 起始物质的量 |
(3)根据平衡常数的定义计算平衡常数的值;
(4)根据改变反应物浓度,对平衡移动的影响判断;
解答:
解:(1)因为达到平衡时Y的浓度为0.2mol/L,即Y的物质的量为0.2×2mol=0.4mol,所以在反应中,X的物质的量减小了0.6mol-0.2mol=0.4mol,Y的物质的量减小了1.6mol-0.4mol=1.2mol,所以有a:3=0.4:1.2=1:3,所以a=1,故答案为:1;
(2)根据转化率=
×100%可知,X的平衡转化率为
×100%=66.7%,故答案为:66.7%;
(3)根据化学方程式可知在平衡时生成Z的物质的量为0.8mol,所以平衡时,X的物质的量浓度为0.1mol/L,Y的物质的量浓度为0.2mol/L,Z的物质的量浓度为0.4mol/L,该条件下平衡常数的值为
=200,故答案为:200;
(4)因为X是反应物,增加反应物浓度,平衡向正反应方向移动,即向右移动,因为X的物质的量增加,所以X的转化率下降,故答案为:向右;减小;
(2)根据转化率=
| 已转化的物质的量 |
| 起始物质的量 |
| 0.4 |
| 0.6 |
(3)根据化学方程式可知在平衡时生成Z的物质的量为0.8mol,所以平衡时,X的物质的量浓度为0.1mol/L,Y的物质的量浓度为0.2mol/L,Z的物质的量浓度为0.4mol/L,该条件下平衡常数的值为
| 0.42 |
| 0.1×0.23 |
(4)因为X是反应物,增加反应物浓度,平衡向正反应方向移动,即向右移动,因为X的物质的量增加,所以X的转化率下降,故答案为:向右;减小;
点评:本题主要考查了根据物质的变化量确定化学反应计量数、转化率、平衡常数计算等知识点,中等难度,解题时注意一些基础知识的运用.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
下列各组反应中最终肯定是白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Ca(OH)2溶液中通入过量SO2气体 |
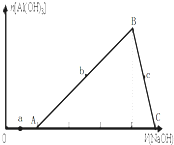 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )| A、在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3-离子仍能大量共存 |
| B、原溶液中盐酸和AlCl3物质的量的浓度之比为1:3 |
| C、若b、c的纵坐标数值相同,则横坐标数值之比为1:3 |
| D、图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O |
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、K2SiO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:
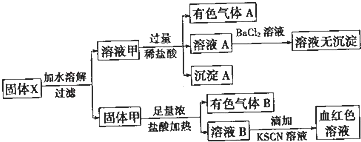
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A、溶液甲中一定含有K2SiO3、NaNO2 |
| B、无法判断溶液中是否有K2SO3 |
| C、气体A和气体B-定为混合物 |
| D、原混合物中一定有Fe2O3 |
做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(H2C2O4乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+C2O42-+H+═CO2↑+Mn2++□
下列有关叙述不正确的是( )
下列有关叙述不正确的是( )
| A、该反应的氧化剂为KMnO4 |
| B、发生还原反应的是C2O42- |
| C、该离子方程式右侧方框内的产物是H2O |
| D、16mol H+参加反应时,电子转移10mol |
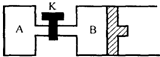 如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.
如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.