题目内容
做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(H2C2O4乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+C2O42-+H+═CO2↑+Mn2++□
下列有关叙述不正确的是( )
下列有关叙述不正确的是( )
| A、该反应的氧化剂为KMnO4 |
| B、发生还原反应的是C2O42- |
| C、该离子方程式右侧方框内的产物是H2O |
| D、16mol H+参加反应时,电子转移10mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:MnO4-+C2O42-+H+═CO2↑+Mn2++□中,Mn元素的化合价降低,C元素的化合价升高,由电子守恒、电荷守恒可知2MnO4-+5C2O42-+16H+═10CO2↑+2Mn2++□,由原子守恒可知□为水,以此来解答.
解答:
解:A.Mn元素的化合价降低,则KMnO4为氧化剂,故A正确;
B.C元素的化合价升高,失去电子,发生氧化反应,则氧化产物为C2O42-,故B错误;
C.由电子、电荷及原子守恒可知,离子反应为2MnO4-+5C2O42-+16H+═10CO2↑+2Mn2++8H2O,故C正确;
D.16mol H+参加反应时,2molMn得到电子,则电子转移为2mol×(7-2)=10mol,故D正确;
故选B.
B.C元素的化合价升高,失去电子,发生氧化反应,则氧化产物为C2O42-,故B错误;
C.由电子、电荷及原子守恒可知,离子反应为2MnO4-+5C2O42-+16H+═10CO2↑+2Mn2++8H2O,故C正确;
D.16mol H+参加反应时,2molMn得到电子,则电子转移为2mol×(7-2)=10mol,故D正确;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
相关题目
下列物质转化在给定的条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③石油化工采用银作催化剂,可以实现一步完成:2CH2=CH2+O2

④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO
⑥NH3
NO
HNO3.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2/点燃 |
| H2O |
③石油化工采用银作催化剂,可以实现一步完成:2CH2=CH2+O2
| Ag |

④Fe2O3
| HCl(aq) |
| △ |
⑤MgCl2(aq)
| 石灰乳 |
| 煅烧 |
⑥NH3
| O2 |
| O2,H2O |
| A、①②③④ | B、①③④⑥ |
| C、①③⑤⑥ | D、②④⑤⑥ |
下列说法中不正确的是( )
| A、Na2O2可做呼吸面具的供氧剂 |
| B、单质硅是生产光导纤维的基本原料 |
| C、目前世界上使用量最大的合金是钢 |
| D、明矾可作净水剂 |
现有100mL只含MgCl2和AlCl3两种溶质的混合溶液,其中c(Cl-)=1.0mol?L-1,c(Mg2+)=0.35mol?L-1要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要2mol?L-1的NaOH溶液的体积是( )
| A、25mL | B、35mL |
| C、45mL | D、55mL |
下列说法不正确的是( )
| A、化石燃料是不可再生的,在地球上的蕴藏量是有限的 |
| B、化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体 |
| C、直接燃烧煤不如将煤进行深加工后再燃烧的效果好 |
| D、将煤处理后变成气体燃料的目的是提高煤的价格 |
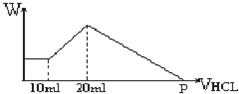 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示: