题目内容
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、K2SiO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:
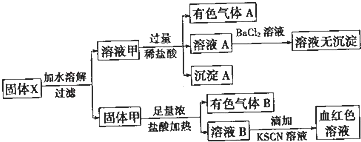
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A、溶液甲中一定含有K2SiO3、NaNO2 |
| B、无法判断溶液中是否有K2SO3 |
| C、气体A和气体B-定为混合物 |
| D、原混合物中一定有Fe2O3 |
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题,实验设计题
分析:有色气体A应为NO2,可能含有CO2气体,说明一定含有NaNO2,固体甲与浓盐酸反应生成有色气体B,B应为Cl2,则应含有MnO2,沉淀A应为H2SiO3,说明含有K2SiO3,则一定不含有MgCl2,溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,以此解答该题.
解答:
解:有色气体A应为NO2,可能含有CO2、SO2等气体,说明一定含有NaNO2,固体甲与浓盐酸反应生成有色气体B,B应为Cl2,则应含有MnO2,沉淀A应为H2SiO3,说明含有K2SiO3,则一定不含有MgCl2,溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,
A.由以上分析可知一定含有K2SiO3、NaNO2,故A正确;
B.因含有NaNO2,如含有K2SO3,二者在酸性条件下发生氧化还原反应生成SO42-,加入氯化钡生成硫酸钡沉淀,加入足量稀盐酸后再加入BaCl2溶液没有沉淀,则一定不含有K2SO3,故B错误;
C.有色气体A应为NO2,可能含有CO2气体,而浓盐酸易挥发,生成的氯气中一定含有HCl气体,气体A可能为纯净物,故C错误;
D.溶液B加KSCN溶液呈血红色,说明含有Fe3+,而固体中可能含有FeO,Fe2+可被氯气氧化生成Fe3+,故D错误.
故选A.
A.由以上分析可知一定含有K2SiO3、NaNO2,故A正确;
B.因含有NaNO2,如含有K2SO3,二者在酸性条件下发生氧化还原反应生成SO42-,加入氯化钡生成硫酸钡沉淀,加入足量稀盐酸后再加入BaCl2溶液没有沉淀,则一定不含有K2SO3,故B错误;
C.有色气体A应为NO2,可能含有CO2气体,而浓盐酸易挥发,生成的氯气中一定含有HCl气体,气体A可能为纯净物,故C错误;
D.溶液B加KSCN溶液呈血红色,说明含有Fe3+,而固体中可能含有FeO,Fe2+可被氯气氧化生成Fe3+,故D错误.
故选A.
点评:本题考查物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,易错点为B和D,注意体会.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
某烃通式为CnH2n,该烃可能为( )
| A、丙烷 | B、丙烯 | C、丙炔 | D、苯 |


 某研究性学习小组做实验做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体大量气体和白色不溶物,该小组同学通过如下实验,验证产物并探究反应原理.
某研究性学习小组做实验做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体大量气体和白色不溶物,该小组同学通过如下实验,验证产物并探究反应原理.
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示: