题目内容
H2(g)+I2(g)?2HI(g)(正反应为放热反应),可逆反应已达化学平衡,下列图象中正确的是( )
A、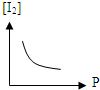 |
B、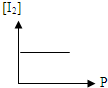 |
C、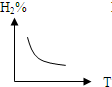 |
D、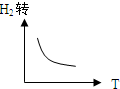 |
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:由于该反应是前后气体体积不变的反应,所以压强改变,平衡不移动,正反应是放热反应,所以升高温度,平衡逆向移动,据此答题.
解答:
解:A.由于该反应是前后气体体积不变的反应,所以压强改变,平衡不移动,随着压强的增大,碘的百分含量不变,但平衡浓度增大,故A错误;
B.由于该反应是前后气体体积不变的反应,所以压强改变,平衡不移动,随着压强的增大,碘的百分含量不变,但平衡浓度增大,故B错误;
C.由于该反应正反应是放热反应,所以升高温度,平衡逆向移动,氢气的百分含量增大,故C错误;
D.正反应是放热反应,所以升高温度,平衡逆向移动,氢气的转化率减小,故D正确;
故选D.
B.由于该反应是前后气体体积不变的反应,所以压强改变,平衡不移动,随着压强的增大,碘的百分含量不变,但平衡浓度增大,故B错误;
C.由于该反应正反应是放热反应,所以升高温度,平衡逆向移动,氢气的百分含量增大,故C错误;
D.正反应是放热反应,所以升高温度,平衡逆向移动,氢气的转化率减小,故D正确;
故选D.
点评:本题主要考查了外界条件对平衡移动的影响,难度较小,解题时注意该反应前后体积不变.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
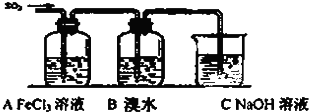
下列物质的反应过程符合如图所示关系的是( )


| A、向CaCl2溶液中通入CO2至过量 |
| B、向澄清石灰水中通入CO2至过量 |
| C、向Na2SiO3溶液中通入CO2至过量 |
| D、AlCl3溶液滴加NaOH溶液至过量 |
下列有关物质的性质和该性质的应用均正确的是( )
| A、氧化镁、氧化铝的熔点都很高,都可用作耐高温材料 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、品红溶液通入二氧化硫,品红褪色,再加热不恢复红色 |
| D、锌的金属活泼性比铁强,可在海轮外壳上装若干锌块以减缓其腐蚀 |
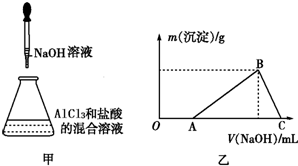
向盛有10mL AlCl3溶液试管,逐渐滴入加NaOH溶液的图象如图,则下列说法不正确的是( )
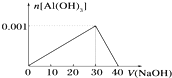

| A、AlCl3溶液的浓度为0.1mol?L-1 |
| B、NaOH溶液的浓度为0.1mol?L-1 |
| C、沉淀最大质量为0.078g |
| D、加入10mL的NaOH溶液与加入38mL的NaOH溶液产生的沉淀质量相同 |