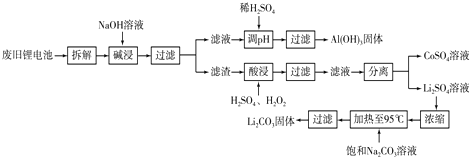
题目内容
下列各组反应中最终肯定是白色沉淀的是( )
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Ca(OH)2溶液中通入过量SO2气体 |
考点:镁、铝的重要化合物,二氧化硫的化学性质,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:A、反应中生成的氢氧化铝只溶于强酸强碱,不溶于弱酸弱碱,故反应生成氢氧化铝和氯化铵后,氢氧化铝不与过量的氨水反应,最终出现氢氧化铝白色沉淀;
B、反应中Al2(SO4)3溶液与KOH溶液反应生成硫酸钾和氢氧化铝,氢氧化铝又溶解在过量的氢氧化钾溶液中,过程中出现白色沉淀,最终无沉淀;
C、反应中FeCl2加入过量的氨水生成氢氧化亚铁白色沉淀,且沉淀不溶于过量的氨水,但氢氧化亚铁在空气中会迅速被氧气氧化,现象为迅速变为灰绿色最后变为红褐色,最终得到红褐色沉淀;
D、Ca(OH)2溶液中通入过量的SO2,反应生成亚硫酸氢钙;
B、反应中Al2(SO4)3溶液与KOH溶液反应生成硫酸钾和氢氧化铝,氢氧化铝又溶解在过量的氢氧化钾溶液中,过程中出现白色沉淀,最终无沉淀;
C、反应中FeCl2加入过量的氨水生成氢氧化亚铁白色沉淀,且沉淀不溶于过量的氨水,但氢氧化亚铁在空气中会迅速被氧气氧化,现象为迅速变为灰绿色最后变为红褐色,最终得到红褐色沉淀;
D、Ca(OH)2溶液中通入过量的SO2,反应生成亚硫酸氢钙;
解答:
解:A、AlCl3溶液中加入过量氨水,反应为AlCl3+3NH3?H2O=AI(OH)3↓+3NH4Cl,生成的白色沉淀不溶于过量的氨水,故A正确
B、Al2(SO4)3溶液中加入过量KOH溶液,反应为Al3++3OH-=AI(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,故B错误;
C、FeCl2溶液中加入过量氨水,反应为Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成红褐色的沉淀,故C错误;
D、向Ca(OH)2溶液中通入过量的SO2,先生成亚硫酸钙沉淀,继续通SO2,亚硫酸钙沉淀继续反应生成亚硫酸氢钙,不会产生沉淀,故D错误;
故选A.
B、Al2(SO4)3溶液中加入过量KOH溶液,反应为Al3++3OH-=AI(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,故B错误;
C、FeCl2溶液中加入过量氨水,反应为Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成红褐色的沉淀,故C错误;
D、向Ca(OH)2溶液中通入过量的SO2,先生成亚硫酸钙沉淀,继续通SO2,亚硫酸钙沉淀继续反应生成亚硫酸氢钙,不会产生沉淀,故D错误;
故选A.
点评:本题考查了氢氧化铝的两性、氢氧化亚铁的还原性等知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A、OA段所发生反应的离子方程式:H++OH-═H2O、CO32-+H+═HCO3- |
| B、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 |
| C、原NaOH溶液的物质的量浓度为0.5 mol?L-1 |
| D、标准状况下产生CO2气体的体积为56mL |
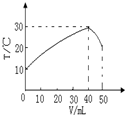 向盛有50mL1.00mol?L-1HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )
向盛有50mL1.00mol?L-1HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列不正确的是( )| A、该实验表明化学能可以转化为热能 |
| B、NaOH溶液的浓度大于1.00mol?L-1 |
| C、V=50mL时,混合液的pH>7 |
| D、该实验表明有水生成的反应都是放热反应 |
下列叙述错误的是( )
| A、葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是平否漏气 |
| C、明矾和漂白粉常用于自来水的净化和杀菌流消毒,两者原理相同 |
| D、化学变化中一定有能量变化,而有能量变化过程不一定发生化学反应 |
既能与盐酸反应,又能与NaOH溶液反应的是( )
①Na2SO3 ②Al(OH)3 ③NaHCO3 ④Al2O3 ⑤NaHSO4 ⑥Al ⑦(NH4)2CO3 ⑧Na2O2.
①Na2SO3 ②Al(OH)3 ③NaHCO3 ④Al2O3 ⑤NaHSO4 ⑥Al ⑦(NH4)2CO3 ⑧Na2O2.
| A、①②③④ | B、②④⑤⑥⑦ |
| C、②③④⑥⑦⑧ | D、全部 |
下列物质的反应过程符合如图所示关系的是( )


| A、向CaCl2溶液中通入CO2至过量 |
| B、向澄清石灰水中通入CO2至过量 |
| C、向Na2SiO3溶液中通入CO2至过量 |
| D、AlCl3溶液滴加NaOH溶液至过量 |