题目内容
19.为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )| A. | 配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质 | |
| C. | 取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质 | |
| D. | 测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸 |
分析 强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,要证明醋酸是弱电解质,只要证明醋酸部分电离即可,据此分析解答.
解答 解:A.配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,氢离子浓度小于醋酸浓度,说明醋酸部分电离,则可证明醋酸为弱电解质,故A正确;
B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个说明醋酸存在电离平衡,则可证明醋酸是弱电解质,故B正确;
C.取等体积等浓度的CH3COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,则醋酸中加入碳酸钠的量多,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故C错误;
D.测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸,说明盐酸中氢离子浓度大于醋酸,则醋酸的电离程度小于盐酸,HCl是强电解质,则醋酸是弱电解质,故D正确;
故选C.
点评 本题考查弱电解质的判断,为高频考点,明确强弱电解质根本区别是解本题关键,不能根据电解质溶解性强弱判断电解质强弱,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )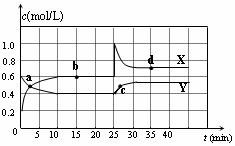

| A. | 图中的两条曲线,X表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)=0.02 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L | |
| D. | 该温度下反应的平衡常数 K=1.11 L/mol |
10.硫酸亚铁易被氧化而变质.为检验某补血剂中硫酸亚铁是否变质,可向该补血剂配成的溶液中加入( )
| A. | AgNO3溶液 | B. | 盐酸酸化的BaCl2溶液 | ||
| C. | KSCN溶液 | D. | HNO3酸化的Ba(NO3)2溶液 |
7.“84”消毒液和漂白粉都是氯气与碱反应在生活中的实际应用,下面说法错误的是( )
| A. | “84”消毒液有漂白和消毒作用 | |
| B. | 工业中将氯气通入石灰乳中制取漂白粉 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 漂白粉在空气中久置失效 |
14.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
| A. | 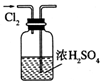 干燥C12 | B. | 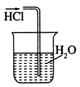 吸收HCl | ||
| C. | 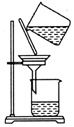 除去粗盐中的不溶物 | D. | 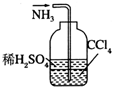 吸收NH3 |
4.下列物质间的转化能一步实现的是( )
| A. | NaNO3→NaCl | B. | SO3→H2SO4 | C. | MgO→Mg(OH)2 | D. | CaCO3→Ca(OH)2 |
11.下列与有机物相关的说法正确的是( )
| A. | 乙烯能使溴水、酸性高锰酸钾溶液褪色,褪色的本质相同 | |
| B. | 乙烷和乙烯分别与C12反应均有1.2二氯乙烷生成,且反应类型不同 | |
| C. | 油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都能水解 | |
| D. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
8. 在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )
在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )
 在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )
在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )| A. | 反应速率:a>b>c | B. | 达到平衡时A的转化率大小:b>a>c | ||
| C. | 若T2>T1.则正反应一定是吸热反应 | D. | 达到平衡时,n( AB3)的大小:b>a>c |