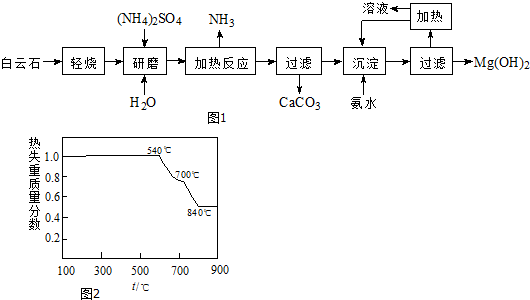
题目内容
7.“84”消毒液和漂白粉都是氯气与碱反应在生活中的实际应用,下面说法错误的是( )| A. | “84”消毒液有漂白和消毒作用 | |
| B. | 工业中将氯气通入石灰乳中制取漂白粉 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 漂白粉在空气中久置失效 |
分析 “84”消毒液由氢氧化钠和氯气反应生成,有效成分为NaClO,漂白粉为石灰乳与氯气反应生成,有效成分为Ca(ClO)2,以此解答该题.
解答 解:A.“84”消毒液有效成分为NaClO,NaClO具有强氧化性,具有漂白和消毒作用,故A正确;
B.工业制备漂白粉的方法是氯气和石灰乳反应,故B正确;
C.氯气和氢氧化钙反应生成CaCl2和Ca(ClO)2,有效成分为Ca(ClO)2,故C错误;
D.Ca(ClO)2可与空气中的二氧化碳反应,可生成碳酸钙和不稳定的次氯酸,故D正确.
故选C.
点评 本题以化学与生活为载体考查卤素及其化合物的性质,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,注意漂白粉的有效成分和成分的区别,难度不大.

练习册系列答案
相关题目
17.恒容容器中,2SO2(g)+O2(g)?2SO3 (g)△H=-296.6kJ/mol,下列判断不正确的是( )
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 平衡后再加入1molSO3,SO2的转化率增大 |
18.下列实验中,所选装置不合理的是( )
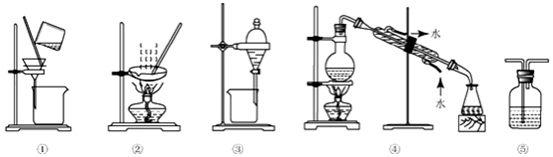

| A. | 粗盐提纯,选①和② | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 分离Na2CO3溶液和CCl4,选④ | D. | 用FeC12溶液吸收C12,选⑤ |
15.在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )
| A. | 乙烯 乙二醇: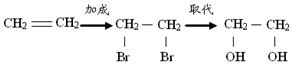 | |
| B. | 溴乙烷 乙醇:CH3CH2Br$\stackrel{水解}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷 1,3-丁二烯: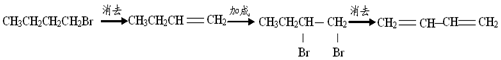 | |
| D. | 乙烯 乙炔: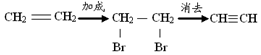 |
2.在某温度下,可逆反应mA+nB?pC+qD的平衡常数为K,下列说法正确的是( )
| A. | K随压强的改变而改变 | B. | K越大,C的平衡浓度越小 | ||
| C. | C的起始浓度越大,K值越大 | D. | K越大,反应进行的程度越大 |
12.己知下列几个反应的化学方程式:
①2FeCl2+Cl2═2FeCl3
②2FeCl3+2HI═2FeCl2+I2+2HCl
③I2+Na2S═2NaI+S
下列有关物质的氧化性的强弱排列顺序中正确的是( )
①2FeCl2+Cl2═2FeCl3
②2FeCl3+2HI═2FeCl2+I2+2HCl
③I2+Na2S═2NaI+S
下列有关物质的氧化性的强弱排列顺序中正确的是( )
| A. | Cl2>Fe3+>I2>S | B. | Cl2>I2>Fe3+>S | C. | Cl2>Fe3+>S>I2 | D. | Fe3+>I2>C12>S |
19.为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
| A. | 配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质 | |
| C. | 取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质 | |
| D. | 测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸 |
16.下列叙述正确的是( )
| A. | 4g氢气中含有的原子数是2mol | |
| B. | 4g氢气所占的体积是44.8L | |
| C. | 4g氢气的物质的量是2mol | |
| D. | 4g氢气与44.8L氧气所占有的体积相同 |