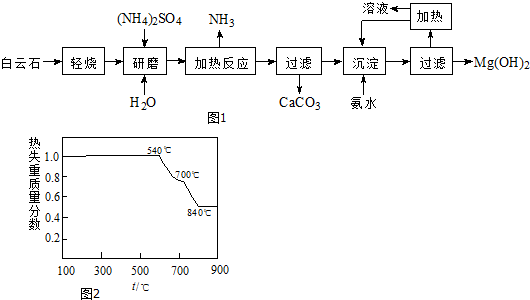
题目内容
8.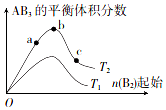 在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )
在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )| A. | 反应速率:a>b>c | B. | 达到平衡时A的转化率大小:b>a>c | ||
| C. | 若T2>T1.则正反应一定是吸热反应 | D. | 达到平衡时,n( AB3)的大小:b>a>c |
分析 对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,则另一种反应物的转化率增大,生成物的物质的量增多,反应速率增大;升高温度平衡向吸热方向移动.
解答 解:A、根据图象可知,a、b、c各点中B的起始物质的量依次增大,则反应物的浓度依次增大,反应速率依次增大,故A错误;
B、根据图象可知,a、b、c各点中B的起始物质的量依次增大,对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,则另一种反应物的转化率增大,则达到平衡时A2的转化率大小为:a<b<c,故B错误;
C、若T2>T1,由图象可知温度升高生成物的物质的量增大,说明升高温度平衡向正反应分析移动,则正反应为吸热反应,故C正确;
D、对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,生成物的物质的量增多,所以达到平衡时,AB3的物质的量大小为:c>b>a,故D错误;
故选C.
点评 本题考查化学平衡移动图象题,题目难度不大,本题注意浓度对化学反应速率和化学平衡移动的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列实验中,所选装置不合理的是( )
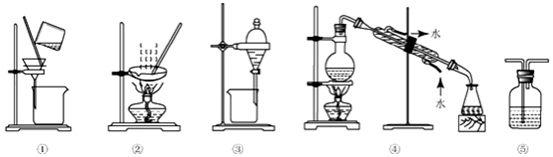

| A. | 粗盐提纯,选①和② | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 分离Na2CO3溶液和CCl4,选④ | D. | 用FeC12溶液吸收C12,选⑤ |
19.为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
| A. | 配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质 | |
| C. | 取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质 | |
| D. | 测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸 |
16.下列叙述正确的是( )
| A. | 4g氢气中含有的原子数是2mol | |
| B. | 4g氢气所占的体积是44.8L | |
| C. | 4g氢气的物质的量是2mol | |
| D. | 4g氢气与44.8L氧气所占有的体积相同 |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 酸性溶液中:Ca2+、Na+、PO43-、NO3- | |
| B. | 0.1 mol•L-1Na2S溶液中:Ag+、Fe3+、NO3-、Cl- | |
| C. | 无色溶液中:K+、H+、Cl-、MnO4- | |
| D. | 0.1 mol•L-1 NaOH溶液中:K+、Na+、SO42-、CO32- |
13.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g)平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的三倍,再达平衡时,测得A的浓度降低为0.15mol/L.下列有关判断错误的是( )
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
5.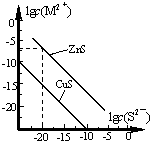 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时,Ksp(CuS)约为1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+浓度均为10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5 mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |
3.25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,下列表示甲醇燃烧热的热方程式是( )
| A. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8kJ•mol-1 | |
| B. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1451.6kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-22.68kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-725.8kJ•mol-1 |