题目内容
14.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )| A. | 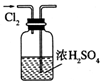 干燥C12 | B. | 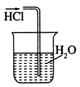 吸收HCl | ||
| C. | 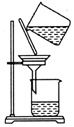 除去粗盐中的不溶物 | D. | 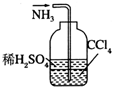 吸收NH3 |
分析 A.干燥时导管应长进短出;
B.HCl极易溶于水,导管在液面下可发生倒吸;
C.过滤时漏斗下端尖端应紧靠烧杯内壁;
D.四氯化碳与水分层,且在下层,隔绝气体与水.
解答 解:A.干燥时导管应长进短出,图中气体的进入方向不合理,故A错误;
B.HCl极易溶于水,导管在液面下可发生倒吸,图中装置可发生倒吸,故B错误;
C.过滤时漏斗下端尖端应紧靠烧杯内壁,图中操作不规范,故C错误;
D.四氯化碳与水分层,且在下层,隔绝气体与水,则图中装置可吸收NH3,并能防止倒吸,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、实验技能、物质的性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
4.甲醇是重要的化工原料和清洁液体燃料.工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
(l)反应①是放热反应(选填“吸热”“放热”.
(2)请写出反应③的平衡常数表达式K3=K1•K2(用K1、K2表).
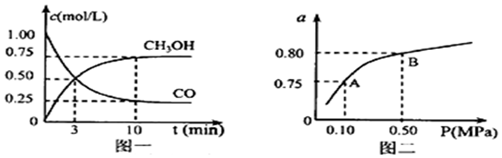
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速υ(H2)=0.15mol/(L•min),若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”、“=”).
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是D
A.容器中总压强不变
B.混台气体的平均摩尔质量不变
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变.
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
(2)请写出反应③的平衡常数表达式K3=K1•K2(用K1、K2表).
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速υ(H2)=0.15mol/(L•min),若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”、“=”).

(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是D
A.容器中总压强不变
B.混台气体的平均摩尔质量不变
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变.
5.合金是常用的材料.下列产品不属于合金制品的是( )
| A. | 铁锅 | B. | 金属门窗 | C. | 不锈钢餐具 | D. | 水银温度计 |
2.在某温度下,可逆反应mA+nB?pC+qD的平衡常数为K,下列说法正确的是( )
| A. | K随压强的改变而改变 | B. | K越大,C的平衡浓度越小 | ||
| C. | C的起始浓度越大,K值越大 | D. | K越大,反应进行的程度越大 |
9.下列关于钠及其化合物的说法中,不正确的是( )
| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 少量的钠可以保存煤油中,如果露置在空气中会迅速和氧气反应生成过氧化钠 | |
| C. | 钠长期放罝在空气中,最终将变成碳酸钠 | |
| D. | 当钠与硫酸铜溶液反应时,有大量蓝色沉淀出现 |
19.为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
| A. | 配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质 | |
| C. | 取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质 | |
| D. | 测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸 |
6.下列电离方程式,书写正确的是( )
| A. | FeCl3═Fe3++Cl3- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | KMnO4═K++Mn7++4O2- |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 酸性溶液中:Ca2+、Na+、PO43-、NO3- | |
| B. | 0.1 mol•L-1Na2S溶液中:Ag+、Fe3+、NO3-、Cl- | |
| C. | 无色溶液中:K+、H+、Cl-、MnO4- | |
| D. | 0.1 mol•L-1 NaOH溶液中:K+、Na+、SO42-、CO32- |
9.CO2和H2可用于合成甲醇和甲醚.
(1)已知①CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
③H2O(g)═H2O(l)△H=-44kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见表:
①下列关于上述可逆反应的说法正确的是AD
A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态
B.当v正(CO2)=3v逆(H2),反应达平衡状态
C.当n(CO2):n(H2)=1:3时,反应达平衡状态
D.a>60%
②上述反应的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$.
③该反应的△H<0,原因是由表中数据可判断b<55%,可得温度升高,反应物转化率降低,所以正反应放热.
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为60%,混合气体中CO2的体积分数为$\frac{4}{19}$.
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为CH3OH-8e-+8OH-=CO32-+6H2O.
(1)已知①CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
③H2O(g)═H2O(l)△H=-44kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见表:
| 温度 转化率 压强 | 500K | 600K |
| P | 60% | b |
| 1.5P | a | 55% |
A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态
B.当v正(CO2)=3v逆(H2),反应达平衡状态
C.当n(CO2):n(H2)=1:3时,反应达平衡状态
D.a>60%
②上述反应的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$.
③该反应的△H<0,原因是由表中数据可判断b<55%,可得温度升高,反应物转化率降低,所以正反应放热.
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为60%,混合气体中CO2的体积分数为$\frac{4}{19}$.
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为CH3OH-8e-+8OH-=CO32-+6H2O.