题目内容
10.硫酸亚铁易被氧化而变质.为检验某补血剂中硫酸亚铁是否变质,可向该补血剂配成的溶液中加入( )| A. | AgNO3溶液 | B. | 盐酸酸化的BaCl2溶液 | ||
| C. | KSCN溶液 | D. | HNO3酸化的Ba(NO3)2溶液 |
分析 硫酸亚铁若变质,混有铁离子,铁离子遇KSCN变为血红色,以此来鉴别.
解答 解:检验某补血剂中硫酸亚铁是否变质,即检验铁离子,加KSCN溶液若变为血红色,则变质,反之不变质,A、B、D均不能检验,
故选C.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、离子的检验为解答的关键,侧重分析与实验能力的考查,注意离子检验的特征试剂,题目难度不大.

练习册系列答案
相关题目
1.一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到平衡的标志是( )
| A. | 单位时间内生成3n mol X,同时生成n mol Y | |
| B. | 2v逆(Y)=v正(Z) | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
18.下列实验中,所选装置不合理的是( )
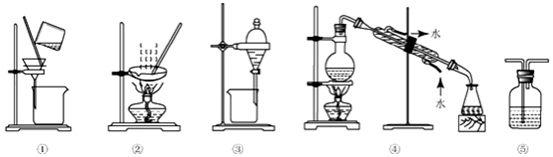

| A. | 粗盐提纯,选①和② | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 分离Na2CO3溶液和CCl4,选④ | D. | 用FeC12溶液吸收C12,选⑤ |
5.合金是常用的材料.下列产品不属于合金制品的是( )
| A. | 铁锅 | B. | 金属门窗 | C. | 不锈钢餐具 | D. | 水银温度计 |
15.在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )
| A. | 乙烯 乙二醇: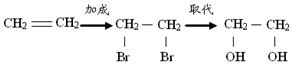 | |
| B. | 溴乙烷 乙醇:CH3CH2Br$\stackrel{水解}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷 1,3-丁二烯: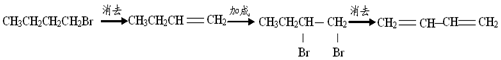 | |
| D. | 乙烯 乙炔: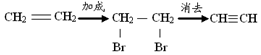 |
2.在某温度下,可逆反应mA+nB?pC+qD的平衡常数为K,下列说法正确的是( )
| A. | K随压强的改变而改变 | B. | K越大,C的平衡浓度越小 | ||
| C. | C的起始浓度越大,K值越大 | D. | K越大,反应进行的程度越大 |
19.为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
| A. | 配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质 | |
| C. | 取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质 | |
| D. | 测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸 |
5.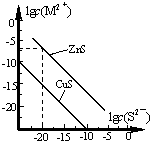 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时,Ksp(CuS)约为1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+浓度均为10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5 mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |