题目内容
设NA为阿伏加德罗常数的值.下列叙述错误的是( )
| A、常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA |
| B、5.6 g铁与500 mL 2 mol?L-1硝酸反应,转移的电子数为0.2NA |
| C、常温常压下,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
| D、V La mol?L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、CO2和N2O摩尔质量为44g/mol,含有电子数分别为22和30,据此计算分析电子数;
B、依据n=
=CV计算物质的量,分析判断铁和稀硝酸反应产物,结合产物计算注意电子数;
C、过氧化钠和水反应,每反应2mol过氧化钠生成1mol氧气,电子转移2mol计算;
D、依据n=CV,结合铁离子水解分析,离子物质的量=溶质物质的量×离子数计算;
B、依据n=
| m |
| M |
C、过氧化钠和水反应,每反应2mol过氧化钠生成1mol氧气,电子转移2mol计算;
D、依据n=CV,结合铁离子水解分析,离子物质的量=溶质物质的量×离子数计算;
解答:
解:A、CO2和N2O摩尔质量为44g/mol,含有电子数分别为22和30,8.8g CO2和N2O混合气体物质的量=
=0.2mol,所含的电子数在4.4NA-17.6NA,故A错误;
B、依据n=
=CV计算物质的量,铁物质的量=
=0.1mol,硝酸物质的量=0.500 L×2 mol?L-1=1mol,分析判断铁和稀硝酸反应产物,n(Fe):n(HNO3)=1:4反应生成硝酸铁,n(Fe):n(HNO3)=3:8反应生成硝酸亚铁,n(Fe):n(HNO3)=0.1:1=1:10<1:4,硝酸过量,生成硝酸铁,依据铁计算电子转移为0.3NA,故B错误;
C、过氧化钠和水反应,每反应2mol过氧化钠生成1mol氧气,电子转移2mol计算,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA,故C正确;
D、依据n=CV=aVmol,结合铁离子水解分析,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023,故D正确;
故选B.
| 8.8g |
| 44g/mol |
B、依据n=
| m |
| M |
| 5.6g |
| 56g/mol |
C、过氧化钠和水反应,每反应2mol过氧化钠生成1mol氧气,电子转移2mol计算,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA,故C正确;
D、依据n=CV=aVmol,结合铁离子水解分析,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023,故D正确;
故选B.
点评:本题考查了阿伏伽德罗常数的分析,氧化还原反应电子转移计算应用,注意产物判断和盐类水解的分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
某金属硝酸盐加热分解生成的NO2和O2的物质的量之比是3:1,则在加热过程中,该金属元素的化合价( )
| A、降低 | B、升高 |
| C、不变 | D、无法确定 |
已知在粗碘中含ICl和IBr,受热时ICl、IBr均可升华;若在粗碘中加入一种物质再进行升华,则可制得精碘.在下列物质中,应加入的物质是( )
| A、H2O |
| B、Zn |
| C、KI |
| D、NaCl |
某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.下列叙述正确的是( )
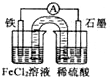

| A、原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B、此电池工作原理与硅太阳能电池工作原理相同 |
| C、Fe为正极,石墨上发生的反应为:2H++2e-═H2↑ |
| D、若装置中的盐桥用铁丝代替,电流表指针无偏转 |
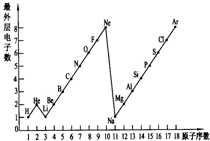 图表是整理数据、发现其中规律的一种重要工具.1~18号元素原子最外层电子数与原子序数的关系如图.试回答:
图表是整理数据、发现其中规律的一种重要工具.1~18号元素原子最外层电子数与原子序数的关系如图.试回答: