题目内容
2.等体积硫酸铝、硫酸锌、硫酸钠溶液分别跟足量氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度之比为( )| A. | 1:2:3 | B. | 1:6:9 | C. | 1:3:4 | D. | 1:3:6 |
分析 结合Al2(SO4)3~3BaSO4、ZnSO4~BaSO4、Na2SO4~BaSO4及c=$\frac{n}{V}$计算.
解答 解:氯化钡足量,则硫酸盐完全反应,若生成的硫酸钡沉淀的质量比为1:2:3,设物质的量分别为1mol、2mol、3mol,
由Al2(SO4)3~3BaSO4、ZnSO4~BaSO4、Na2SO4~BaSO4可知,硫酸铝、硫酸锌、硫酸钠的物质的量分别为$\frac{1}{3}$mol、2mol、3mol,
因溶液的体积相同,则浓度之比等于物质的量之比,即为$\frac{1}{3}$:2:3=1:6:9,
故选B.
点评 本题考查化学反应的计算,为高频考点,把握物质的量的相关计算、原子守恒为解答的关键,侧重分析与计算能力的考查,注意关系式的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
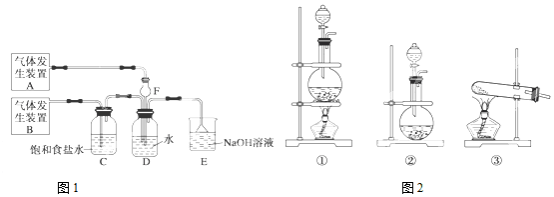
12.能用如图所示装置实施的气体制取方案是( )


| A. | 用饱和食盐水和稀硫酸为原料制取HCl | |
| B. | 用大理石和稀硫酸制取CO2 | |
| C. | 用铁和盐酸为原料制取H2 | |
| D. | 用双氧水和二氧化锰为原料制取O2 |
13.下列离子方程式的书写,正确的是( )
| A. | 足量的烧碱溶液与二氧化碳的反应:OH-+CO2═HCO3- | |
| B. | 盐酸溶液与硝酸银溶液反应:HCl+Ag+═AgCl↓+H+ | |
| C. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
10.在一个容积为VL的密闭容器中放入A(g)和B(g)物质的量比2:1,在一定条件下发生下列反应3A(g)+B(g)═C(g)+2D(g),10分钟达到平衡,混合气体的平均摩尔质量增大$\frac{1}{8}$,则下列说法正确的是( )
| A. | 若容器中密度不变则说明达到化学平衡状态 | |
| B. | A平衡转化率为60% | |
| C. | 平衡常数为$\frac{4}{9}$ | |
| D. | 平衡时D的体积分数25% |
7.一定量的铜与一定量的浓硝酸恰好完全反应生成NO与NO2,反应中被还原的HNO3占HNO3总量的$\frac{1}{3}$,还原产物中NO、NO2的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
14.硼酸(H2BO3)在水中的电离方程式为H3BO3+H2O?[B(OH)4]-+H+.常温下,0.1mol•L-1的H2BO3溶液pH=5.0,.下列说法正确的是( )
| A. | 用该溶液滴定未知浓度的NaOH溶液,用甲堪橙作指示剂 | |
| B. | 加水稀释时,$\frac{c(O{H}^{-})}{c({H}_{3}B{O}_{3})}$减小 | |
| C. | 常温下,加入等体积pH=9的NaOH溶液后,溶液呈中性 | |
| D. | 常温下,向该溶液滴加NaOH溶液至pH=7时,c(Na+)=c([B(OH)4]-)>c(H+)=c(OH-) |
11.LiH可用作制取氢弹的原料,制备反应为2Li(熔融)+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH.下列有关说法不正确的是( )
| A. | 还原性:H2>Li | B. | H-与Li+的电子层结构相同 | ||
| C. | 微粒半径:r(H-)>r(H)>r(H+) | D. | LiH属于离子化合物 |
 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1