题目内容
17.为了探究Cl2、SO2同时通入H2O中发生的反应.某化学兴趣小组同学设计了如图1所示的实验装置.试回答:
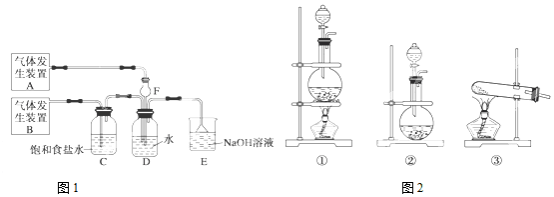
(1)为制取Cl2、SO2气体,小组的同学采用Na2SO3固体与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2.
在此实验中,制取SO2的装置不能(填“能”或“不能”)用启普发生器.原因启普发生器适用于固液混合状态其不需加热而制取的气体,且固体必须是块状的,
而Na2SO3固体为粉末状;气体发生装置B应选择图2三种装置中的①(填序号).
(2)仪器F的作用是防倒吸;装置E的作用是吸收尾气.
(3)D装置中主要反应的化学反应方程式为Cl2+SO2+2H2O═H2SO4+2HCl.
(4)为验证通入D装置中气体是Cl2还是SO2过量,同学们准备了以下试剂:
a.品红溶液b.氯化钡溶液c.NaOH溶液d.氢硫酸e.酸性高锰酸钾溶液f.紫色石蕊溶液
①若Cl2过量:取适量D中溶液滴加至盛有紫色石蕊溶液(填序号)试剂的试管内,能观察到溶液先变红色后无色现象;
②若SO2过量:取适量D中溶液滴加至盛有酸性高锰酸钾(填序号)试剂的试管内,能观察到溶液褪色现象.
分析 (1)启普发生器适用于固液混合状态其不需加热而制取的气体,且固体必须是块状的;根据药品状态和反应条件选择;
(2)气体容易与水反应,且溶解度较大会发生倒吸;装置E的作用是吸收尾气;
(3)D中是二氧化硫和氯气发生的氧化还原反应生成硫酸和盐酸,依据反应产物写出方程式;
(4)①氯气过量,D溶液使紫色石蕊试液先显红色再褪色;
②二氧化硫过量,D溶液有还原性,使酸性高锰酸钾褪色.
解答 解:(1)启普发生器适用于固液混合状态其不需加热而制取的气体,且固体必须是块状的,而Na2SO3固体为粉末状,不能使用启普发生器制取二氧化硫,气体发生装置B为制取氯气,由二氧化锰和浓盐酸加热制备,选用装置①;
故答案为:不能;启普发生器适用于固液混合状态其不需加热而制取的气体,且固体必须是块状的,而Na2SO3固体为粉末状;①;
(2)SO2易与水反应,且溶解度较大会发生倒吸,则F可以防倒吸,二氧化硫和氯气不能直接排放至空气中,用氢氧化钠吸收;
故答案为:防倒吸;吸收尾气;
(3)D中是二氧化硫和氯气发生的氧化还原反应生成硫酸和盐酸,反应的方程式为:Cl2+SO2+2H2O═H2SO4+2HCl;
故答案为:Cl2+SO2+2H2O═H2SO4+2HCl;
(4)为验证通入D装置中气体是Cl2还是SO2过量,
①若Cl2过量:取适量D中溶液滴加至盛有紫色石蕊溶液,溶液先变红色,后无色;
故答案为:紫色石蕊溶液;溶液先变红色,后无色;
②若SO2过量:取适量D中溶液滴加至盛有酸性高锰酸钾溶液,溶液褪色;
故答案为:酸性高锰酸钾溶液;溶液褪色.
点评 本题考查二氧化硫、氯气的性质,明确物质的性质及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
7.短周期主族元素X、Y、Z、W的原子序数依次增大,Y原子核外电子数是X原子最外层电子数的2倍,Y、W同主族,离子化合物ZY不溶于水.下列叙述正确的是( )
| A. | 离子半径:W>Y>Z | |
| B. | Z的单质不能与水反应 | |
| C. | 简单氢化物的沸点:W>Y | |
| D. | 最高价氧化物对应的水化物的酸性:X>W |
5.下列化学用语表示正确的是( )
| A. | 乙炔的结构简式:CHCH | B. | OH-的电子式: | ||
| C. | F-的结构示意图: | D. | CCl4的比例模型: |
2.等体积硫酸铝、硫酸锌、硫酸钠溶液分别跟足量氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度之比为( )
| A. | 1:2:3 | B. | 1:6:9 | C. | 1:3:4 | D. | 1:3:6 |
6.甲、乙、丙符合如图所示转化关系,甲是( )


| A. | NH3 | B. | SiO2 | C. | Al2O3 | D. | Mg |

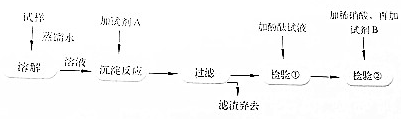
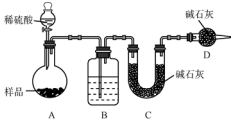 某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.
某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.