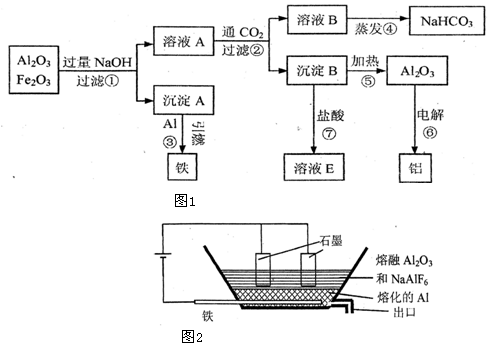
题目内容
10.在一个容积为VL的密闭容器中放入A(g)和B(g)物质的量比2:1,在一定条件下发生下列反应3A(g)+B(g)═C(g)+2D(g),10分钟达到平衡,混合气体的平均摩尔质量增大$\frac{1}{8}$,则下列说法正确的是( )| A. | 若容器中密度不变则说明达到化学平衡状态 | |
| B. | A平衡转化率为60% | |
| C. | 平衡常数为$\frac{4}{9}$ | |
| D. | 平衡时D的体积分数25% |
分析 10分钟达到平衡,混合气体的平均摩尔质量增大$\frac{1}{8}$,A(g)和B(g)物质的量比2:1,设物质的量分别为6mol、3mol,则平衡后物质的量变为8mol,则
3A(g)+B(g)═C(g)+2D(g)
开始 6 3 0 0
转化 3x x x 2x
平衡 6-3x 3-x x 2x
可知6-3x+3-x+x+2x=8,解得x=1mol,
A.混合气体的质量、体积始终不变;
B.A的转化率为$\frac{3mol}{6mol}$×100%;
C.K=$\frac{\frac{1mol}{VL}×(\frac{2mol}{VL})^{2}}{(\frac{3mol}{VL})^{3}(\frac{2mol}{V})}$;
D.平衡时D的体积分数为$\frac{2mol}{8mol}$×100%.
解答 解:10分钟达到平衡,混合气体的平均摩尔质量增大$\frac{1}{8}$,由M=$\frac{m}{n}$可知,反应前后的物质的量比为9:8,由A(g)和B(g)物质的量比2:1,设物质的量分别为6mol、3mol,则平衡后物质的量变为8mol,则
3A(g)+B(g)═C(g)+2D(g)
开始 6 3 0 0
转化 3x x x 2x
平衡 6-3x 3-x x 2x
可知6-3x+3-x+x+2x=8,解得x=1mol,
A.混合气体的质量、体积始终不变,则密度不变,不能说明达到化学平衡状态,故A错误;
B.A的转化率为$\frac{3mol}{6mol}$×100%=50%,故B错误;
C.K=$\frac{\frac{1mol}{VL}×(\frac{2mol}{VL})^{2}}{(\frac{3mol}{VL})^{3}(\frac{2mol}{V})}$=$\frac{2V}{27}$,故C错误;
D.平衡时D的体积分数为$\frac{2mol}{8mol}$×100%=25%,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握摩尔质量与物质的量的关系、平衡三段法、K及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意结合平衡浓度计算K,题目难度不大.

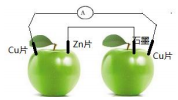 如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )
如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )| A. | 该装置为两个原电池串联 | B. | Zn片为电源负极 | ||
| C. | 两个Cu片均不参加反应 | D. | 石墨上有O2生成 |
| A. | 甲酸与硬脂酸 | B. | 甲醇与甘油 | C. | 苯酚与苯甲醇 | D. | 苯与苯乙烯 |
| A. | 乙炔的结构简式:CHCH | B. | OH-的电子式: | ||
| C. | F-的结构示意图: | D. | CCl4的比例模型: |
| A. | 等于2.0Kpa | B. | 等于1.5Kpa | C. | 大于1.5bKpa | D. | 小于1.5bKpa |
| A. | 1:2:3 | B. | 1:6:9 | C. | 1:3:4 | D. | 1:3:6 |
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | 新制氯水和过氯化钠都能使红墨水褪色 | |
| C. | 漂白粉和水玻璃长期暴露在空气中都会变质 | |
| D. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 |