题目内容
14.硼酸(H2BO3)在水中的电离方程式为H3BO3+H2O?[B(OH)4]-+H+.常温下,0.1mol•L-1的H2BO3溶液pH=5.0,.下列说法正确的是( )| A. | 用该溶液滴定未知浓度的NaOH溶液,用甲堪橙作指示剂 | |
| B. | 加水稀释时,$\frac{c(O{H}^{-})}{c({H}_{3}B{O}_{3})}$减小 | |
| C. | 常温下,加入等体积pH=9的NaOH溶液后,溶液呈中性 | |
| D. | 常温下,向该溶液滴加NaOH溶液至pH=7时,c(Na+)=c([B(OH)4]-)>c(H+)=c(OH-) |
分析 A、NaH2BO3水解显碱性,据指示剂的变色范围分析;
B、硼酸加水稀释,溶液酸性减弱;
C、常温下,向0.1mol•L-1pH=5.0的H3BO3溶液中加入等体积pH=9的NaOH溶液后,得到硼酸和硼酸钠的混合溶液;
D、向硼酸溶液中滴加NaOH溶液至pH=7时,据电荷守恒分析离子浓度大小.
解答 解:A、用硼酸滴定未知浓度的NaOH溶液,用酚酞作指示剂,故A错误;
B、硼酸加水稀释,溶液酸性减弱,氢氧根离子浓度增大,硼酸分子浓度减小,故B错误;
C、硼酸和硼酸钠的混合溶液显酸性,故C错误;
D、据电荷守恒向该溶液滴加NaOH溶液至pH=7时,c(Na+)=c([B(OH)4]-),并远远大于c(H+)=c(OH-),故D正确;
故选D.
点评 本题考查了弱酸与强碱中和滴定时指示剂选择、弱酸加水稀释时的离子浓度变化、弱酸与强碱中和滴定时离子浓度变化,注意酸碱指示剂的变色范围,题目难度不大.

练习册系列答案
相关题目
5.下列化学用语表示正确的是( )
| A. | 乙炔的结构简式:CHCH | B. | OH-的电子式: | ||
| C. | F-的结构示意图: | D. | CCl4的比例模型: |
2.等体积硫酸铝、硫酸锌、硫酸钠溶液分别跟足量氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度之比为( )
| A. | 1:2:3 | B. | 1:6:9 | C. | 1:3:4 | D. | 1:3:6 |
19.下列叙述不正确的是( )
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | 新制氯水和过氯化钠都能使红墨水褪色 | |
| C. | 漂白粉和水玻璃长期暴露在空气中都会变质 | |
| D. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 |
6.甲、乙、丙符合如图所示转化关系,甲是( )


| A. | NH3 | B. | SiO2 | C. | Al2O3 | D. | Mg |
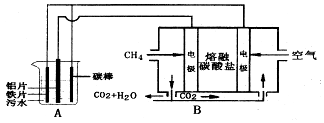
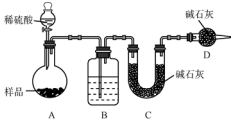 某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.
某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.