题目内容
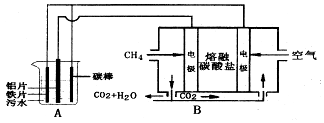
12.能用如图所示装置实施的气体制取方案是( )
| A. | 用饱和食盐水和稀硫酸为原料制取HCl | |
| B. | 用大理石和稀硫酸制取CO2 | |
| C. | 用铁和盐酸为原料制取H2 | |
| D. | 用双氧水和二氧化锰为原料制取O2 |
分析 由制备实验装置可知,为固体与液体反应制备气体,且不需要加热,气体的密度比空气密度大,为向上排空气法收集,以此来解答.
解答 解:饱和食盐水和稀硫酸不反应,不能制备HCl,故A不选;
B.生成硫酸钙微溶,包裹在碳酸钙的表面,阻止反应的发生,故B不选;
C.氢气的密度比空气密度小,应选向下排空气法收集,故C不选;
D.为固体与液体反应生成氧气,且氧气的密度比空气密度大,可利用向上排空气法收集,故D选;
故选D.
点评 本题考查制备实验评价,为高频考点,把握实验装置的作用、实验技能、气体的制备原理为解答的关键,侧重分析与实验能力的考查,注意气体的性质,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
3.某化学小组同学用下列装置(气密性已检验)进行实验.
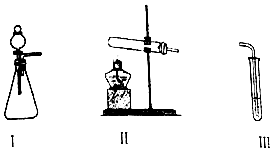
探究O2与KI溶液发生反应的条件.
①甲、乙同学选用以下试剂进行实验(0.1mol•L-1KI溶液,30%H2O2溶液、0.1mol•L-1H2SO4溶液、淀粉溶液、MnO2固体、KMnO4固体),实验记录如表.
甲制取O2的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
乙实验中O2与KI溶液反应的离子方程式是O2+4I-+4H+=2I2+2H2O.
②甲用II加入试剂替换I后,III中仍加入KI、淀粉溶液,再次实验时III中溶液不变蓝.由此他猜测第一次实验时可能是I中的白雾使溶液变蓝.甲又将I中产生的气体直接通入下列a溶液(填序号),证明了白雾中含有H2O2.
a.酸性KMnO4 b.FeCl2 c.Na2S
③由甲、乙两同学的实验,可得出结论:KI溶液在酸性条件下易被O2氧化.

探究O2与KI溶液发生反应的条件.
①甲、乙同学选用以下试剂进行实验(0.1mol•L-1KI溶液,30%H2O2溶液、0.1mol•L-1H2SO4溶液、淀粉溶液、MnO2固体、KMnO4固体),实验记录如表.
| 操作 | 现象 | |
| 甲 | 向I中加入必要的试剂,并向III中加入KI、淀粉溶液.连接I、III,打开活塞 | I中剧烈反应,产生无色气体并伴随大量白雾;III中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向II中加入必要的试剂,并向III中加入KI、淀粉溶液和稀硫酸.连接II、III,点燃酒精灯 | III中有气泡冒出,溶液变蓝 |
乙实验中O2与KI溶液反应的离子方程式是O2+4I-+4H+=2I2+2H2O.
②甲用II加入试剂替换I后,III中仍加入KI、淀粉溶液,再次实验时III中溶液不变蓝.由此他猜测第一次实验时可能是I中的白雾使溶液变蓝.甲又将I中产生的气体直接通入下列a溶液(填序号),证明了白雾中含有H2O2.
a.酸性KMnO4 b.FeCl2 c.Na2S
③由甲、乙两同学的实验,可得出结论:KI溶液在酸性条件下易被O2氧化.
20. 如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )
如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )
 如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )
如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )| A. | 该装置为两个原电池串联 | B. | Zn片为电源负极 | ||
| C. | 两个Cu片均不参加反应 | D. | 石墨上有O2生成 |
7.短周期主族元素X、Y、Z、W的原子序数依次增大,Y原子核外电子数是X原子最外层电子数的2倍,Y、W同主族,离子化合物ZY不溶于水.下列叙述正确的是( )
| A. | 离子半径:W>Y>Z | |
| B. | Z的单质不能与水反应 | |
| C. | 简单氢化物的沸点:W>Y | |
| D. | 最高价氧化物对应的水化物的酸性:X>W |
17.同温同压下,相同体积的下列气体中,质量最大的是( )
| A. | 氯气 | B. | 氢气 | C. | 氧气 | D. | 氮气 |
2.等体积硫酸铝、硫酸锌、硫酸钠溶液分别跟足量氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度之比为( )
| A. | 1:2:3 | B. | 1:6:9 | C. | 1:3:4 | D. | 1:3:6 |