题目内容
9.现有常温下的六份溶液:①0.01mol•L-1 CH3COOH溶液;②0.01mol•L-1盐酸;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol•L-1 CH3COOH溶液与pH=12的氨水等体积混合所得溶液;⑥0.01mol•L-1盐酸与pH=12的NaOH溶液等体积混合所得溶液.(1)其中水的电离程度最大的是⑤(选填序号,下同),水的电离程度相同的是②③④.
(2)将①④混合,若有c(CH3COO-)>c(H+),则混合液可能呈A、B、C(填字母序号).
A.酸性 B.碱性 C.中性
(3)常温下,用水稀释①0.01mol•L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是AD(填字母序号).
A.n(H+) B.c(H+)
C.c(CH3COOH):c(CH3COO-) D.c(OH-)
(4)CO2可转化成有机物实现碳循环:CO2$\stackrel{H_{2}}{→}$CH3OH$\stackrel{O_{2}}{→}$HCOOH…
用离子方程式表示HCOONa溶液呈碱性的原因HCOO-+H2O=HCOOH+OH-,写出该反应的平衡常数(Kh)表达式:Kh=$\frac{c(HCOOH)×c(O{H}^{-})}{c(HCO{O}^{-})}$,升高温度,Kh增大(选填“增大”“减小”或“不变”).
(5)新型高效的甲烷燃料电池采用铂为电极材料,电解质为④pH=12的NaOH溶液,两电极上分别通入CH4和O2.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示.
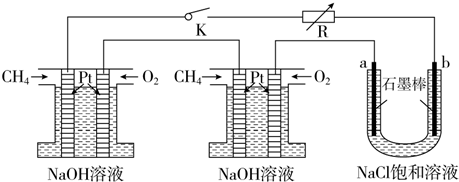
回答下列问题:
①甲烷燃料电池负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O.
②闭合开关K后,电解氯化钠溶液的总反应方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
③若每个电池甲烷通入量为1L(标准状况),电解池中产生的氯气体积为4L(标准状况).
分析 (1)酸碱抑制水的电离,易水解的盐促进水的电离;溶液中H+或OH-浓度越大,对水的电离的抑制程度越大;
(2)根据溶液的组成分析;
(3)用水稀释①0.01mol•L-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,由于体积增大程度较大,所以氢离子浓度减小;
(4)HCOONa溶液水解呈碱性;根据水解常数的含义书写;水解反应为吸热反应;
(5)①甲烷碱性燃料电池中正极氧气得电子被还原,负极甲烷失电子被氧化;
②电解氯化钠溶液生成氯气、氢气和NaOH;
③根据关系式1 mol CH4~8 mol e-~4 mol Cl2计算.
解答 解:(1)0.01mol•L-1CH3COOH溶液与pH=12的氨水等体积所得溶液是醋酸铵和氨水溶液,其中醋酸根离子和铵根离子水解对水的电离起到促进作用,水的电离程度最大,而酸或是碱都对水的电离起抑制作用,②0.01mol•L-1盐酸中氢离子浓度为0.01mol/L,则氢氧根离子浓度为10-12mol/L,盐酸中氢氧根离子全部由水电离,即水电离出的氢离子或氢氧根离子的浓度也是10-12mol/L,③pH=12的氨水中水电离出的氢离子浓度是10-12mol/L,pH=12的NaOH溶液中,水电离出的氢离子浓度也是10-12mol/L,水的电离程度相同的是②③④;
故答案为:⑤;②③④;
(2)0.01mol•L-1 CH3COOH溶液与pH=12的NaOH溶液混合,混合后溶液中c(CH3COO-)>c(H+),则溶液中的溶质可能为CH3COONa或CH3COONa和CH3COOH,CH3COONa和NaOH,则溶液可能显碱性、酸性、中性;
故答案为:A、B、C;
(3)A.用水稀释①0.01mol•L-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,故A正确;
B.用水稀释①0.01mol•L-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,由于体积增大程度较大,所以氢离子浓度减小,故B错误;
C.加水稀释Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变,c(H+)减小,所以$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小,故C错误;
D.c(H+)减小,Kw不变,所以c(OH-)增大,故D正确.
故答案为:AD;
(4)HCOONa溶液水解呈碱性,水解方程式为:HCOO-+H2O=HCOOH+OH-;化学平衡常数=$\frac{生成物浓度幂的积}{反应物浓度幂的积}$,已知水解方程为HCOO-+H2O?HCOOH+OH-,故Kh=$\frac{c(HCOOH)×c(O{H}^{-})}{c(HCO{O}^{-})}$;水解反应为吸热反应,温度升高,水解平衡正移,K值增大;
故答案为:HCOO-+H2O=HCOOH+OH-;$\frac{c(HCOOH)×c(O{H}^{-})}{c(HCO{O}^{-})}$;增大;
(5)①在碱性溶液中,甲烷燃料电池的总反应式为:CH4+2O2+2OH-=CO32-+3H2O,正极是:2O2+4H2O+8e-═8OH-,负极是:CH4-8e-+10OH-═CO32-+7H2O.
故答案为:CH4+10OH--8e-=CO32-+7H2O;
②电解氯化钠溶液生成氯气、氢气和NaOH,其电解方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
③根据得失电子守恒,可得:1 mol CH4~8 mol e-~4 mol Cl2,故若每个电池甲烷通入量为1 L(标准状况),生成4×1L=4L Cl2;
故答案为:4.
点评 本题考查了弱电解质的电离、盐的水解原理及应用、原电池原理和电解原理的应用等,题目难度中等,注意在书写Kh的表达式时水的浓度不能写入,因为水溶液中水的浓度为常数.

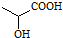 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 葡萄糖和乳酸含有相同的官能团 | |
| B. | 向葡萄糖溶液加入氢氧化铜悬浊液,加热一定有砖红色沉淀生成 | |
| C. | 乳酸能发生催化氧化、加成和取代反应 | |
| D. | 分子式C3H6O3,且含有羟基、羧基的有机物共有2种 |
| A. | 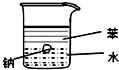 证明密度ρ(苯)<ρ(钠)<ρ(水) | B. | 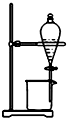 分离酒精和四氯化碳 | ||
| C. | 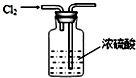 干燥Cl2 | D. | 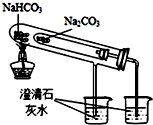 比较NaHCO3和Na2CO3的热稳定性 |
| 选项 | 溶液 | 粒子浓度关系 |
| A | CH3COOK溶液中加入少量NaNO3固体后 | c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| B | 新制氯水 | c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C | NH4HSO4溶液 | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) |
| D | 0.1mol•L-1,pH为4的NaHB溶液 | c(HB-)>c(H2B)>c(B2-) |
| A. | A | B. | B | C. | C | D. | D |
 ,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)
,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)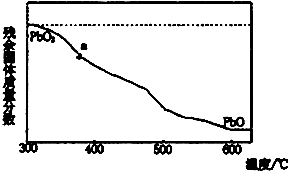 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
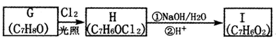
 .
. .
. .
. .
.