题目内容
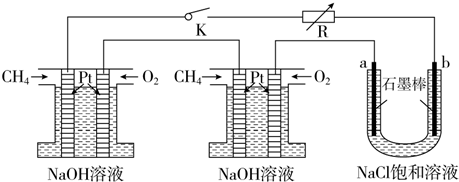
17. (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3已知PbO2与硝酸不反应且氧化性强于硝酸,而PbO是碱性氧化物,能和酸反应,写出上述分解产物与硝酸反应的化学方程式Pb2O3+2HNO3=PbO2+Pb(NO3)2+H2O
(2)①另一实验小组也取一定量的PbO2加热得到了一些固体,为探究该固体的组成,取一定质量该固体加人到30mLCH3COOH一CH3COONa溶液中,再加入足量KI固体,摇荡锥瓶使固体中的PbO2与KI全部反应而溶解,得到棕色溶液.写出PbO2参与该反应的化学方程式PbO2+2KI+4CH3COOH=(CH3COO)2Pb+2CH3COOK+I2+2H2O,用淀粉指示剂,0.2mol/L的Na2S2O3标准溶液滴定.至溶液蓝色刚消失为止(2Na2S2O3+I2═Na2S4O6+2NaI),Na2S2O3标准溶液的消耗量为20mL.
②固体加入到醋酸而非盐酸中是因为会产生有毒气体,写出反应的化学方程式PbO2+4HCl=PbCl2+Cl2↑+H2O用CH3COOH一CH3COONa的混合液而不用CH3COOH可以控制pH不至于过低,否则会产生浑浊和气体,请写出该反应的化学方程式Na2S2O3+2CH3COOH=2CH3COONa+S↓+SO2↑+H2O
③取相同质量的上述固体与硝酸混合,过滤出的滤液加入足量的铬酸钾溶液得到铬酸铅(PbCrO2相对分子质量323)沉淀,然后过滤、洗涤、干燥,得固体质童为0.969g,依据上述数据,该固体的分子式Pb5O7.
分析 (1)a点残余固体质量分数为96.66%,则残余固体质量为478g×99.66%,加热过程中Pb元素质量不变,则Pb元素物质的量为478g÷239g/mol=2mol,残留固体中O元素质量为478g×99.66%-2mol×207g/mol=48g,则O原子物质的量为48g÷16g/mol=3,Pb、O原子数目之比为2:3,故a点化学式为Pb2O3,相当于PbO2、PbO按物质的量1:1混合,由题目信息可知,Pb2O3与硝酸反应生成PbO2、Pb(NO3)2与水;
(2)①CH3COOH一CH3COONa溶液中PbO2与KI全部反应而溶解,得到棕色溶液,说明生成碘单质,PbO2被还原生成醋酸铅,还生醋酸钾与水;
②PbO2具有强氧化性,可以将盐酸中氯离子氧化为氯气,同时生成PbCl2与水;酸性条件下Na2S2O3会反应得到S、SO2;
③分离互不相溶的固体与液体,应采取过滤方法,并需要洗涤、干燥,所得固体相当于PbO2、PbO的混合物,根据PbO2~I2~2Na2S2O3计算PbO2的物质的量,再根据PbO~Pb(NO3)2~PbCrO2计算PbO的物质的量,进而确定固体化学式.
解答 解:(1)a点残余固体质量分数为96.66%,则残余固体质量为478g×99.66%,加热过程中Pb元素质量不变,则Pb元素物质的量为478g÷239g/mol=2mol,残留固体中O元素质量为478g×99.66%-2mol×207g/mol=48g,则O原子物质的量为48g÷16g/mol=3,Pb、O原子数目之比为2:3,故a点化学式为Pb2O3,相当于PbO2、PbO按物质的量1:1混合,由题目信息可知,Pb2O3与硝酸反应生成PbO2、Pb(NO3)2与水,反应方程式为:Pb2O3+2HNO3=PbO2+Pb(NO3)2+H2O,
故答案为:Pb2O3;Pb2O3+2HNO3=PbO2+Pb(NO3)2+H2O;
(2)①CH3COOH一CH3COONa溶液中PbO2与KI全部反应而溶解,得到棕色溶液,说明生成碘单质,PbO2被还原生成醋酸铅,还生醋酸钾与水,反应方程式为:PbO2+2KI+4CH3COOH=(CH3COO)2Pb+2CH3COOK+I2+2H2O,
故答案为:PbO2+2KI+4CH3COOH=(CH3COO)2Pb+2CH3COOK+I2+2H2O;
②PbO2具有强氧化性,可以将盐酸中氯离子氧化为氯气,同时生成PbCl2与水,反应方程式为:PbO2+4HCl=PbCl2+Cl2↑+H2O,
酸性条件下Na2S2O3会反应得到S、SO2,反应方程式为:Na2S2O3+2CH3COOH=2CH3COONa+S↓+SO2↑+H2O,
故答案为:PbO2+4HCl=PbCl2+Cl2↑+H2O;Na2S2O3+2CH3COOH=2CH3COONa+S↓+SO2↑+H2O;
③采取过滤方法分离出固体,再洗涤、干燥,所得固体相当于PbO2、PbO的混合物,
根据PbO2~I2~2Na2S2O3,可知n(PbO2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.02L×0.2mol/L=0.002mol,根据PbO~Pb(NO3)2~PbCrO2,可知n(PbO)=n(PbCrO2)=$\frac{0.969}{323g/mol}$=0.003mol,故PbO2、PbO的物质的量之比为0.002mol:0.003mol=2:3,则固体化学式为Pb5O7,
故答案为:过滤、洗涤、干燥;Pb5O7.
点评 本题考查化学方程式计算、物质组成测定等,是对学生综合能力的考查,注意知识的迁移应用是关键,难度中等.

步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响
(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成浅红色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
I.由乙二醛催化氧化制乙醛酸的反应如下:
2OHC-CHO(g)+O2(g)?2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表:
| 化学键 | O=O | C-O | O-H | C-H |
| 键能(kJ•mol-1) | 498 | 351 | 465 | 413 |
(2)一定条件下,按照$\frac{n({O}_{2})}{n(OHC-CHO)}$=$\frac{1}{2}$投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图1所示.
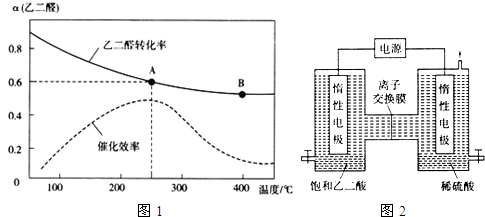
①该反应在A点放出的热量>(填“>”、“=”或“<”)B点放出的热量.
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由.不正确,温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小
③图中A点时,乙醛酸的体积分数为50%.
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有增大压强或及时分离出乙醛酸(列举一条).
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图2所示.
(1)图中的离子交换膜为阳(填“阳”或“阴”)膜.
(2)稀硫酸的作用为提供氢离子,作电解质溶液.
(3)生成乙醛酸的电极反应式为HOOC-COOH+2H++2e-→OHC-COOH+H2O.
| A. | 同质量、不同密度的N2和CO | B. | 同密度、同体积的H2和N2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同温度、同体积的N2O和CO2 |
 东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是
东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是( )
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿乃中药,宜采取水煎煮熬汁的方法服用 | |
| C. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取 | |
| D. | 青蒿素分子中有2种非极性键和3种极性键 |
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,说明溶液中含有K+ | |
| B. | 向某无色溶液中滴加BaCl2溶液有白色沉淀出现,说明该溶液中一定含有SO42- | |
| C. | 向某溶液中加AgNO3溶液和稀盐酸,有白色沉淀出现,说明该溶液中一定含有Cl- | |
| D. | 向某溶液中加NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明该溶液中一定含有NH4+ |
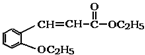 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,E为中间产物(结构简式为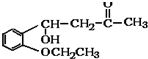 )其合成路线如图:
)其合成路线如图:
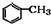 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$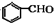
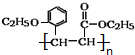 .
.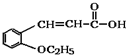 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$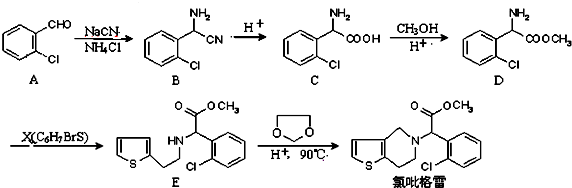
 .
. .
.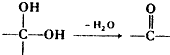
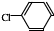 中氯原子较难水解
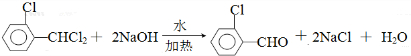
中氯原子较难水解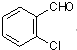 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
、 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式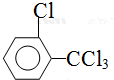 、
、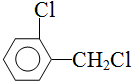 .
.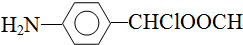 .
.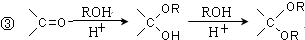
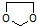 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: