题目内容
2.原子序数分别为1、11、17的三种元素X、Y、Z两两组合的化合物XZ含有的化学键类别为共价键,YZ电子式为 ,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)
,Z元素在周期表中的位置为第三周期第ⅥⅠA族族,能否用下面的反应证明Z的非金属性比碳强:2HCl+Na2CO3=NaCl+H2O+CO2↑否(填“能”或“否”)
分析 三种元素分别为H、Na、Cl的三种元素X、Y、Z两两组合的化合物HCl含有的化学键类别为共价键,氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ;氯是三个周期,最外层7个电子,所以在周期表中的位置为第三周期第ⅥⅠA族,反应2HCl+Na2CO3=NaCl+H2O+CO2↑只能说明盐酸的酸性强于碳酸,盐酸是无氧酸,而碳酸是含氧酸,应通过比较最高价含氧酸的酸性,得出两者的非金属性强弱,由此分析解答.
;氯是三个周期,最外层7个电子,所以在周期表中的位置为第三周期第ⅥⅠA族,反应2HCl+Na2CO3=NaCl+H2O+CO2↑只能说明盐酸的酸性强于碳酸,盐酸是无氧酸,而碳酸是含氧酸,应通过比较最高价含氧酸的酸性,得出两者的非金属性强弱,由此分析解答.
解答 解:三种元素分别为H、Na、Cl的三种元素X、Y、Z两两组合的化合物HCl含有的化学键类别为共价键,氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ;氯是三个周期,最外层7个电子,所以在周期表中的位置为第三周期第ⅥⅠA族,反应2HCl+Na2CO3=NaCl+H2O+CO2↑只能说明盐酸的酸性强于碳酸,而不能证明氯的非金属性比碳强,故答案为:共价键;
;氯是三个周期,最外层7个电子,所以在周期表中的位置为第三周期第ⅥⅠA族,反应2HCl+Na2CO3=NaCl+H2O+CO2↑只能说明盐酸的酸性强于碳酸,而不能证明氯的非金属性比碳强,故答案为:共价键; ;三;ⅥⅠA族;否.
;三;ⅥⅠA族;否.
点评 本题考查元素在周期表中的位置及性质递变规律和酸性比较等知识,侧重于学生的分析能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO3-、K+ | 稀硫酸 | 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
C | Ba2+、HCO3-、Cl- | 氢氧化钠溶液 | HCO3-+ OH-=CO32-+H2O |
D | Al3+、Cl-、NO3- | 过量氢氧化钠溶液 | Al3++3 OH-=Al(OH)3↓ |
10.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+相当于1mol H+],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响
(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成浅红色.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.101 0mol/L,则该样品中氮的质量分数为18.85%.
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响
(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成浅红色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
17.用0.1000mol•L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2-3次 | |
| B. | 可使用酚酞或甲基橙作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准溶液的刻度时,滴定前平视,滴定后仰视,测定结果偏高 |
10.乙醛酸(OHC-COOH)是合成名贵香料的原料之一.
I.由乙二醛催化氧化制乙醛酸的反应如下:
2OHC-CHO(g)+O2(g)?2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表:
计算上述反应的△H=-308kJ•mol-1.
(2)一定条件下,按照$\frac{n({O}_{2})}{n(OHC-CHO)}$=$\frac{1}{2}$投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图1所示.
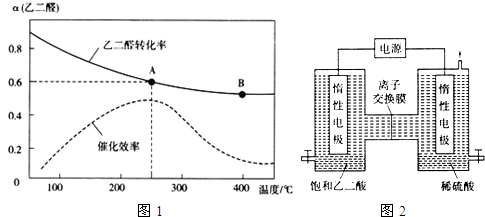
①该反应在A点放出的热量>(填“>”、“=”或“<”)B点放出的热量.
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由.不正确,温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小
③图中A点时,乙醛酸的体积分数为50%.
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有增大压强或及时分离出乙醛酸(列举一条).
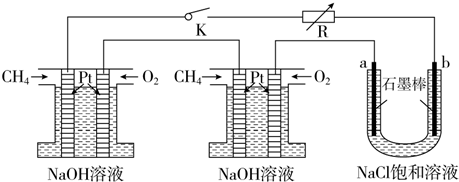
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图2所示.
(1)图中的离子交换膜为阳(填“阳”或“阴”)膜.
(2)稀硫酸的作用为提供氢离子,作电解质溶液.
(3)生成乙醛酸的电极反应式为HOOC-COOH+2H++2e-→OHC-COOH+H2O.
I.由乙二醛催化氧化制乙醛酸的反应如下:
2OHC-CHO(g)+O2(g)?2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表:
| 化学键 | O=O | C-O | O-H | C-H |
| 键能(kJ•mol-1) | 498 | 351 | 465 | 413 |
(2)一定条件下,按照$\frac{n({O}_{2})}{n(OHC-CHO)}$=$\frac{1}{2}$投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图1所示.

①该反应在A点放出的热量>(填“>”、“=”或“<”)B点放出的热量.
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由.不正确,温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小
③图中A点时,乙醛酸的体积分数为50%.
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有增大压强或及时分离出乙醛酸(列举一条).
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图2所示.
(1)图中的离子交换膜为阳(填“阳”或“阴”)膜.
(2)稀硫酸的作用为提供氢离子,作电解质溶液.
(3)生成乙醛酸的电极反应式为HOOC-COOH+2H++2e-→OHC-COOH+H2O.
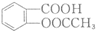 和
和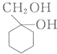 的流程路线.
的流程路线.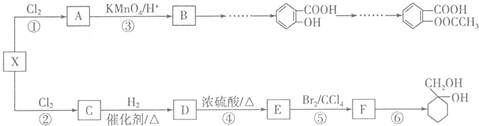
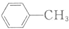 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$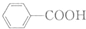
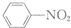 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$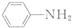 (苯胺,易被氧化)
(苯胺,易被氧化)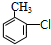 .
.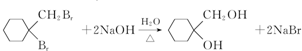 .
.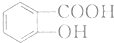 有多种同分异构体,写出符合下列条件的同分异构体的结构简式
有多种同分异构体,写出符合下列条件的同分异构体的结构简式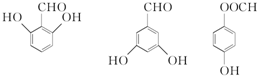 (任写一种).
(任写一种).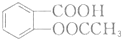 的结构与性质,说法正确的是AD.
的结构与性质,说法正确的是AD.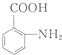 最合理的方案,请在答题纸的方框中表示.
最合理的方案,请在答题纸的方框中表示.