题目内容
下列物质按照氧化物、单质、碱、混合物、纯净物的顺序排列正确的是( )
| A、氯酸钾、碳单质、液态氯化钠、液氨、王水 |
| B、双氧水、稀有气体、碱式碳酸镁、硫酸铜溶液、明矾 |
| C、烧碱、纯碱、火碱、天然气、乙酸 |
| D、二氧化锰、硫单质(S8)、NH3?H2O、纯净空气、H2O和D2O组成的混合物 |
考点:酸、碱、盐、氧化物的概念及其相互联系
专题:物质的分类专题
分析:由两种元素组成,一种元素是氧元素的化合物属于氧化物,
由一种元素组成的纯净物属于单质,
水溶液中电离处的阴离子全部是氢氧根离子的化合物为碱,
由两种或两种以上物质组成的物质属于混合物,
由一种物质组成的物质属于纯净物.
由一种元素组成的纯净物属于单质,
水溶液中电离处的阴离子全部是氢氧根离子的化合物为碱,
由两种或两种以上物质组成的物质属于混合物,
由一种物质组成的物质属于纯净物.
解答:
解:A、氯酸钾属于盐不是氧化物、碳属于单质、液态氯化钠属于盐、液氨属于纯净物、王水是硝酸和盐酸的混合物,故A错误;
B、双氧水属于氧化物、稀有气体是单质、碱式碳酸镁属于盐、硫酸铜溶液是溶液属于混合物、明矾属于盐是硫酸铝钾,属于纯净物,故B错误;
C、烧碱属于碱不是氧化物、纯碱是盐、火碱是氢氧化钠属于碱、天然气是混合物、乙酸属于纯净物,故C错误;
D、二氧化锰属于氧化物、硫单质(S8)属于单质、NH3?H2O是弱碱、纯净空气属于混合物、H2O和D2O组成的是纯净物,故D正确.
故选D.
B、双氧水属于氧化物、稀有气体是单质、碱式碳酸镁属于盐、硫酸铜溶液是溶液属于混合物、明矾属于盐是硫酸铝钾,属于纯净物,故B错误;
C、烧碱属于碱不是氧化物、纯碱是盐、火碱是氢氧化钠属于碱、天然气是混合物、乙酸属于纯净物,故C错误;
D、二氧化锰属于氧化物、硫单质(S8)属于单质、NH3?H2O是弱碱、纯净空气属于混合物、H2O和D2O组成的是纯净物,故D正确.
故选D.
点评:本题考查了物质分类和概念实质的理解应用,主要是纯净物与混合物的区别:是否由一种物质组成,单质和化合物的区别是:是否由同种元素组成,氧化物是由两种元素组成、一种是氧元素,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )| A、K与N相接时,电解池密度增大 |
| B、K与N相接时,H+向负极区迁移 |
| C、K与M连接时,所用电源的b极为负极 |
| D、K与M相接时,阳极附近的pH逐渐减小 |
气态废弃物中的硫化氢可用电化学的方法转化为可利用的硫:配制一份电解质溶液,主要成分为:K4[Fe(CN)6](200g/L)和KHCO3(60g/L);通电电解,通入H2S气体.过程中涉及硫化氢转化为硫的总反应:2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,则下列说法不正确的是( )
| A、电解过程中的阳极反应为:[Fe(CN)6]2--e-=[Fe(CN)6]3- |
| B、电解过程中阴极附近溶液的pH降低 |
| C、电解过程中每处理l mol硫化氢气体,理论上转移电子2 mol |
| D、该处理方法理论上不需要补充电解质溶液 |

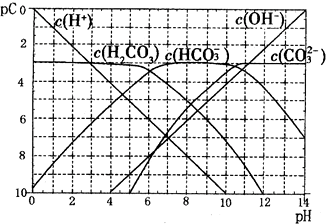

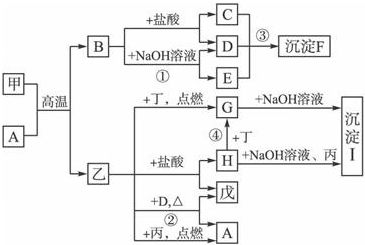 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.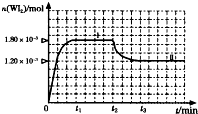 卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.