题目内容
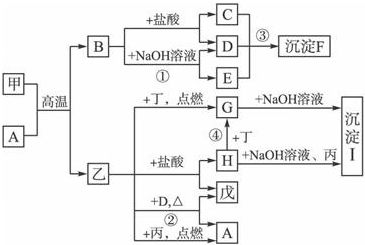 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.请填写下列空白:
(1)物质A的化学式是
(2)反应①的离子方程式是
(3)反应②的化学方程式是
考点:无机物的推断
专题:推断题
分析:既能与盐酸又能与NaOH溶液反应的化合物B从Al2O3和Al(OH)3中选择,由甲和A的反应可推断知B为Al2O3,此时C为AlCl3,E为NaAlO2(或Na[Al(OH)4]),D为H2O,F为Al(OH)3,能与盐酸反应的单质乙为金属单质,结合B为Al2O3,可知生成B(Al2O3)和乙(金属单质)的反应为铝热反应,则乙为Fe,甲为Al,乙(Fe)与HCl反应生成的单质戊为H2,化合物H为FeCl2,乙(Fe)与D(H2O)反应生成的A为Fe3O4,则丙为O2,沉淀Ⅰ为Fe(OH)3,乙(Fe)能在其中燃烧的单质丁只能为Cl2,G为FeCl3,以此解答该题.
解答:
解:既能与盐酸又能与NaOH溶液反应的化合物B从Al2O3和Al(OH)3中选择,由甲和A的反应可推断知B为Al2O3,此时C为AlCl3,E为NaAlO2(或Na[Al(OH)4]),D为H2O,F为Al(OH)3,能与盐酸反应的单质乙为金属单质,结合B为Al2O3,可知生成B(Al2O3)和乙(金属单质)的反应为铝热反应,则乙为Fe,甲为Al,乙(Fe)与HCl反应生成的单质戊为H2,化合物H为FeCl2,乙(Fe)与D(H2O)反应生成的A为Fe3O4,则丙为O2,沉淀Ⅰ为Fe(OH)3,乙(Fe)能在其中燃烧的单质丁只能为Cl2,G为FeCl3,
(1)由以上分析可知A为Fe3O4,甲为Al,原子结构示意图为 ,故答案为:Fe3O4;
,故答案为:Fe3O4; ;
;
(2)反应①为氧化铝和氢氧化钠的反应,生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)反应②为铁和水的反应,方程式为3Fe+4H2O
Fe3O4+4H2,故答案为:3Fe+4H2O
Fe3O4+4H2.
(1)由以上分析可知A为Fe3O4,甲为Al,原子结构示意图为
 ,故答案为:Fe3O4;
,故答案为:Fe3O4; ;
;(2)反应①为氧化铝和氢氧化钠的反应,生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)反应②为铁和水的反应,方程式为3Fe+4H2O
| ||
| ||
点评:本题考查无机物的推断,为高频考点和常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握题目的突破口,难度中等.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
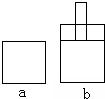 如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.
如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.Ⅰ、向a和b中充入等物质的量的NO2,发生反应:2NO2?N2O4;△H<0;
Ⅱ、向a和b中充入等物质的量的N2O4,发生反应:N2O4?2NO2;△H>0.
以下判断对Ⅰ、Ⅱ两种情况均正确的是( )
| A、反应起始时,两容器内反应速率va和vb的关系为:va=vb |
| B、反应过程中,两容器内反应速率va和vb的关系为:va<vb |
| C、反应达平衡时,两容器内反应物的转化率αa和αb的关系为:αa<αb |
| D、反应达平衡时,两容器内压强Pa和Pb的关系为:Pa>Pb |
下列物质按照氧化物、单质、碱、混合物、纯净物的顺序排列正确的是( )
| A、氯酸钾、碳单质、液态氯化钠、液氨、王水 |
| B、双氧水、稀有气体、碱式碳酸镁、硫酸铜溶液、明矾 |
| C、烧碱、纯碱、火碱、天然气、乙酸 |
| D、二氧化锰、硫单质(S8)、NH3?H2O、纯净空气、H2O和D2O组成的混合物 |
若溶液中由水电离产生的c(OH-)=1×10-14 mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、K+、NH4+、SO42-、NO3- |
| B、Ca2+、Al3+、HCO3-、Cl- |
| C、MnO4-、K+、SO42-、Na+ |
| D、Na+、Fe2+、NO3-、SCN- |
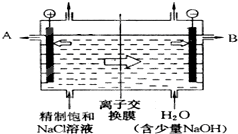 工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图:
工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图: