题目内容
某兴趣小组拟利用如下图装置探究验证干燥的Cl2和潮湿的Cl2有无漂白性.
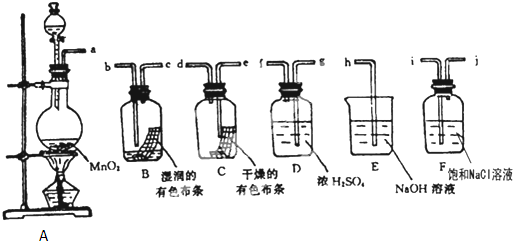
回答下列问题:
(1)A装置中的主要玻璃仪器有:导管、酒精灯、圆底烧瓶、 .
A装置中发生反应的化学方程式是 .
(2)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接 , 接 , 接 , 接 , 接 .
(3)A装置中发生反应,产生Cl2后,从集气瓶B、C中有色布条的现象可得出的结论是 ;其中发生反应的化学方程式为 .
(4)F装置中饱和NaCl溶液作用为 .D装置中浓 H2SO4作用为 .
(5)烧杯E中发生反应的化学方程式为 .
(6)工业生产漂白粉的化学方程式
在反应中消耗2mol氯气,则转移了 mol电子.
(7)工业上可用氨与Cl2反应检验输送氯气的管道是否漏气,反应方程式如下:8NH3+3Cl2═6NH4Cl+N2.该反应中, 是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为 mol,被氧化的物质有 mol.

回答下列问题:
(1)A装置中的主要玻璃仪器有:导管、酒精灯、圆底烧瓶、
A装置中发生反应的化学方程式是
(2)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接
(3)A装置中发生反应,产生Cl2后,从集气瓶B、C中有色布条的现象可得出的结论是
(4)F装置中饱和NaCl溶液作用为
(5)烧杯E中发生反应的化学方程式为
(6)工业生产漂白粉的化学方程式
在反应中消耗2mol氯气,则转移了
(7)工业上可用氨与Cl2反应检验输送氯气的管道是否漏气,反应方程式如下:8NH3+3Cl2═6NH4Cl+N2.该反应中,
考点:探究氯水、氯气的漂白作用
专题:卤族元素
分析:(1)A装置中玻璃仪器还有分液漏斗,浓盐酸和二氧化锰反应生成氯化锰、氯气和水;
(2)其连接顺序是:反应装置→洗气装置→干燥装置→检验装置→尾气处理装置;
(3)干燥的氯气不能使干燥的有色布条褪色,但能使湿润的有色布条褪色,氯气和水反应生成HCl和HClO;
(4)饱和食盐水能除去HCl而抑制氯气溶解;浓硫酸具有吸水性;
(5)氯气和NaO反应生成氯化钠、次氯酸钠和水;
(6)氯气和氢氧化钙反应生成而制备漂白粉;该反应中有一半的氯气作氧化剂一半的氯气作还原剂;
(7)8NH3+3Cl2═6NH4Cl+N2中部分N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以氯气是氧化剂、部分氨气是还原剂,作还原剂的氨气占参加反应氨气的
.
(2)其连接顺序是:反应装置→洗气装置→干燥装置→检验装置→尾气处理装置;
(3)干燥的氯气不能使干燥的有色布条褪色,但能使湿润的有色布条褪色,氯气和水反应生成HCl和HClO;
(4)饱和食盐水能除去HCl而抑制氯气溶解;浓硫酸具有吸水性;
(5)氯气和NaO反应生成氯化钠、次氯酸钠和水;
(6)氯气和氢氧化钙反应生成而制备漂白粉;该反应中有一半的氯气作氧化剂一半的氯气作还原剂;
(7)8NH3+3Cl2═6NH4Cl+N2中部分N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以氯气是氧化剂、部分氨气是还原剂,作还原剂的氨气占参加反应氨气的
| 1 |
| 4 |
解答:
解:(1)A装置中玻璃仪器还有分液漏斗,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,故答案为:分液漏斗;MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑;
(2)其连接顺序是:反应装置→洗气装置→干燥装置→检验装置→尾气处理装置,A是反应装置、B和C是检验装置、D是干燥装置、E是尾气处理装置、F是洗气装置,所以其连接顺序是a 接i,j接g,f接e,d接b,c接h,故答案为:i;j;g;f;e;d;b;c;h;
(3)B中没有水,C中有水,氯气溶于水得到氯水,B中有色布条褪色、C中有色布条褪色,说明干燥的Cl2没有漂白性,氯水有漂白性;氯气和水反应方程式为Cl2+H2O?HCl+HClO,
故答案为:干燥的Cl2没有漂白性,氯水有漂白性;Cl2+H2O?HCl+HClO;
(4)浓盐酸具有挥发性,加热促进挥发,所以制取的氯气中含有HCl,HCl极易溶于水,氯化钠中含有氯离子抑制氯气溶解,所以氯化钠的作用是除去氯气中的HCl;浓硫酸具有吸水性,所以能除去氯气中的水,
故答案为:除Cl2中的HCl;除Cl2中的H2O;
(5)氯气和NaO反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(6)氯气和氢氧化钙反应生成而制备漂白粉,反应方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;该反应中有一半的氯气作氧化剂一半的氯气作还原剂,所以该反应中有2mol氯气参加反应,有1mol氯气被氧化,则转移电子的物质的量=1mol×2×(1-0)=2mol,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;2;
(7)8NH3+3Cl2═6NH4Cl+N2中部分N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以氯气是氧化剂、部分氨气是还原剂,作还原剂的氨气占参加反应氨气的
,若反应中有1.5mol氧化剂氯气参与反应,则发生转移的电子的物质的量=1.5mol×2×(1-0)=3mol,被氧化的物质物质的量=
×2=1mol,
故答案为:NH3;3;1.
| ||
| ||
(2)其连接顺序是:反应装置→洗气装置→干燥装置→检验装置→尾气处理装置,A是反应装置、B和C是检验装置、D是干燥装置、E是尾气处理装置、F是洗气装置,所以其连接顺序是a 接i,j接g,f接e,d接b,c接h,故答案为:i;j;g;f;e;d;b;c;h;
(3)B中没有水,C中有水,氯气溶于水得到氯水,B中有色布条褪色、C中有色布条褪色,说明干燥的Cl2没有漂白性,氯水有漂白性;氯气和水反应方程式为Cl2+H2O?HCl+HClO,
故答案为:干燥的Cl2没有漂白性,氯水有漂白性;Cl2+H2O?HCl+HClO;
(4)浓盐酸具有挥发性,加热促进挥发,所以制取的氯气中含有HCl,HCl极易溶于水,氯化钠中含有氯离子抑制氯气溶解,所以氯化钠的作用是除去氯气中的HCl;浓硫酸具有吸水性,所以能除去氯气中的水,
故答案为:除Cl2中的HCl;除Cl2中的H2O;
(5)氯气和NaO反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(6)氯气和氢氧化钙反应生成而制备漂白粉,反应方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;该反应中有一半的氯气作氧化剂一半的氯气作还原剂,所以该反应中有2mol氯气参加反应,有1mol氯气被氧化,则转移电子的物质的量=1mol×2×(1-0)=2mol,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;2;
(7)8NH3+3Cl2═6NH4Cl+N2中部分N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以氯气是氧化剂、部分氨气是还原剂,作还原剂的氨气占参加反应氨气的
| 1 |
| 4 |
| 1.5mol |
| 3 |
故答案为:NH3;3;1.
点评:本题考查氯气的实验室制法、氧化还原反应计算等知识点,侧重考查实验基本操作、计算能力,难点是仪器连接顺序的排列,注意(7)中氨气部分做还原剂,为易错点.

练习册系列答案
相关题目
已知某温度下CH3COOH和NH3?H2O 的电离常数相等.现向10mL浓度为0.1mol?L?1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,下列说法不正确的是( )
| A、水的电离程度先增大,后又减小 |
| B、c(CH3COOH)与c(CH3COO?)之和始终保持不变 |
| C、溶液导电性先增强后减弱 |
| D、当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) |
 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.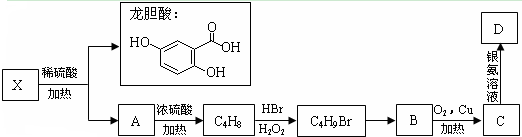
 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验: 试回答下列问题:
试回答下列问题: