题目内容
 试回答下列问题:
试回答下列问题:(1)已知24g A和40g B恰好完全反应生成0.4molC和32g D,则C的摩尔质量为
(2)把1molNa和1mol Mg分别投入到两份体积3L浓度1mol/L的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为
②标准状况下,1.00L水(密度:1.00g?cm-3)吸收
③现需480mL2.0mol/L的盐酸需用量筒量取
考点:配制一定物质的量浓度的溶液,物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据质量守恒计算生成C的质量,再根据M=
计算其摩尔质量;
(2)钠溶于盐酸后,溶液增加的质量=钠的质量-氢气的质量,镁溶于盐酸后,溶液增加的质量=镁的质量-氢气的质量;
(3))①C=
;
②先设氯化氢的体积,根据氯化氢的体积计算其质量,再根据质量发生公式计算氯化氢的体积;
③根据溶液稀释定律C浓V浓=C稀V稀来计算;根据容量瓶只有一条刻度线,只能配制出其对应规格的体积的溶液来分析;根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
| m |
| n |
(2)钠溶于盐酸后,溶液增加的质量=钠的质量-氢气的质量,镁溶于盐酸后,溶液增加的质量=镁的质量-氢气的质量;
(3))①C=
| 1000ρω |
| M |
②先设氯化氢的体积,根据氯化氢的体积计算其质量,再根据质量发生公式计算氯化氢的体积;
③根据溶液稀释定律C浓V浓=C稀V稀来计算;根据容量瓶只有一条刻度线,只能配制出其对应规格的体积的溶液来分析;根据c=
| n |
| V |
解答:
解:(1)根据质量守恒得C的质量=24gA+40g-32g=32g,M=
=
=80g/mol,故答案为:80g/mol;
(2)3L浓度1mol/L的盐酸中HCl的物质的量为3mol,与1mol钠和1mol镁反应时盐酸均过量,钠和镁均完全反应,故生成的氢气的物质的量取决于钠和镁.1mol钠和盐酸反应生成0.5mol氢气,1mol镁和足量盐酸反应生成1mol氢气,
氯化钠溶液中增加的质量=23g/mol×1mol-0.5mol×2g/mol=22g,
氯化镁溶液中增加的质量=24g/mol×1mol-1mol×2g/mol=22g,所以溶液a和b的质量大小关系为ma=mb,
故答案为:=;
(3))①C=
=
=11.9mol/L,故答案为:11.9;
②设HCl的体积为VL,标况下,氯气的值量=
×36.5g,水的质量=1000mL×1.00g?cm-3=1000g,
其质量分数=
×100%=36.5%
解得V=353,
故答案为:353.
③由于无480mL容量瓶,故应选用500mL容量瓶,配制出500mL2.0mol/L的溶液,设需要的浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
11.9mol/L×VmL=500mL×2.0mol/L
解得V=84.7mL;
量筒的洗涤液应倒入废液缸,如果也注入容量瓶,会导致溶质偏多,则所配溶液浓度偏高,即浓度大于2mol/L.故答案为:84.7,500,>.
| m |
| n |
| 32g |
| 0.4mol |
(2)3L浓度1mol/L的盐酸中HCl的物质的量为3mol,与1mol钠和1mol镁反应时盐酸均过量,钠和镁均完全反应,故生成的氢气的物质的量取决于钠和镁.1mol钠和盐酸反应生成0.5mol氢气,1mol镁和足量盐酸反应生成1mol氢气,
氯化钠溶液中增加的质量=23g/mol×1mol-0.5mol×2g/mol=22g,
氯化镁溶液中增加的质量=24g/mol×1mol-1mol×2g/mol=22g,所以溶液a和b的质量大小关系为ma=mb,
故答案为:=;
(3))①C=
| 1000ρω |
| M |
| 1000×1.19g/mL×36.5% |
| 36.5g/mol |
②设HCl的体积为VL,标况下,氯气的值量=
| V |
| 22.4 |
其质量分数=
| ||
|
解得V=353,
故答案为:353.
③由于无480mL容量瓶,故应选用500mL容量瓶,配制出500mL2.0mol/L的溶液,设需要的浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
11.9mol/L×VmL=500mL×2.0mol/L
解得V=84.7mL;
量筒的洗涤液应倒入废液缸,如果也注入容量瓶,会导致溶质偏多,则所配溶液浓度偏高,即浓度大于2mol/L.故答案为:84.7,500,>.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、C4H8O2的同分异构体中能与NaOH反应的有5种 |
| B、等质量的有机物完全燃烧后生成的CO2的量相同,则这两种有机物的实验式一定相同 |
| C、石蜡油分解的实验中,碎瓷片的作用是催化作用和积蓄热量产生高温 |
| D、将甲烷与氯气的混合气体置于密闭容器中放置光亮的地方,一段时间后,装置内的气体有甲烷、氯气、氯化氢、一氯甲烷,二氯甲烷 |
下列关于物质的检验说法不正确的是( )
| A、向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- |
| B、将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含K+ |
| C、待检液逐滴加入NaOH溶液,有白色胶状沉淀产生后来沉淀逐渐消失,则原溶液中可能含有Al3+ |
| D、待检液中先加入KSCN溶液,无明显现象,再加入氯水溶液显血红色,则待检液中一定含有Fe2+ |
 甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.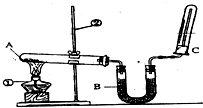 某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题:
 如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.