题目内容
(1)工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),实验测得
CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示.
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是 (填“吸热”或“放热”)反应;
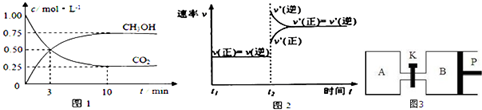
②从反应开始到第三分钟,氢气的平均反应速率v(H2)= mol?L-1?min-1;
③平衡时CH3OH的体积分数为 .
(2)图3中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1.2molCH3OH(g)和2.4molH2O(g),向B容器中充入1.5molCH3OH(g) 和3.0molH2O(g),两容器分别发生上述(1)中反应的逆反应.已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.4aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L.(连通管中气体体积忽略不计,且不考虑温度的影响)
(3)一定条件下的密闭容器中,反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H<0
达到平衡时,要提高CO的转化率,可以采取的措施是 (填字母代号)
A.升温 B.加压 C.增加CO的浓度D.分离出二甲醚(CH3OCH3) E.加入催化剂
(4)已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=100.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下.下列说法正确的是
A.CH3OH的起始浓度为2.1mol/L
B.平衡时CH3OH的浓度为0.9mol/L
C.此时正反应速率大于逆反应速率
D.平衡时CH3OH的转化率小于80%
| 催化剂 |
| 加热加压 |
CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示.
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是

②从反应开始到第三分钟,氢气的平均反应速率v(H2)=
③平衡时CH3OH的体积分数为
(2)图3中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1.2molCH3OH(g)和2.4molH2O(g),向B容器中充入1.5molCH3OH(g) 和3.0molH2O(g),两容器分别发生上述(1)中反应的逆反应.已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.4aL,容器B中CH3OH转化率为
(3)一定条件下的密闭容器中,反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H<0
达到平衡时,要提高CO的转化率,可以采取的措施是
A.升温 B.加压 C.增加CO的浓度D.分离出二甲醚(CH3OCH3) E.加入催化剂
(4)已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=100.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下.下列说法正确的是
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol L -1 | 0.9 | 0.60 | 0.60 |
B.平衡时CH3OH的浓度为0.9mol/L
C.此时正反应速率大于逆反应速率
D.平衡时CH3OH的转化率小于80%
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:(1)①由图2可知,正、逆反应速率都增大,为升高温度,且逆反应速率增大更多,反应向逆反应进行,据此判断;
②由图可知,前3min时二氧化碳的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,根据v=
算v(CO2),再利用速率之比等于化学计量数之比计算v(H2);
③利用三段式计算出反应混合物各组分的平衡时的浓度,计算的平衡浓度,转化率,根据体积分数的定义计算CH3OH的体积分数;
(2)恒温、恒压条件下,气体的体积之比等于其物质的量之比,根据气体的体积计算参加反应的甲醇的物质的量,再根据转化率公式计算转化率;
打开K,AB组成的是恒温恒压容器,依据压强变化和物质的量变化成正比计算得到;
(3)一定条件下的密闭容器中,反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H<0,达到平衡时,要提高CO的转化率,可以采取的措施是使平衡正向进行,结合化学平衡移动原理分析选项;
(4)设平衡时转化的浓度为x,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:x O 0
转化:1.2 0.6 0.6
某时刻:0.9 0.6 0.6
结合平衡常数概念和浓度积常数比较分析计算得到,以此解答该题.
②由图可知,前3min时二氧化碳的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,根据v=
| △c |
| △t |
③利用三段式计算出反应混合物各组分的平衡时的浓度,计算的平衡浓度,转化率,根据体积分数的定义计算CH3OH的体积分数;
(2)恒温、恒压条件下,气体的体积之比等于其物质的量之比,根据气体的体积计算参加反应的甲醇的物质的量,再根据转化率公式计算转化率;
打开K,AB组成的是恒温恒压容器,依据压强变化和物质的量变化成正比计算得到;
(3)一定条件下的密闭容器中,反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H<0,达到平衡时,要提高CO的转化率,可以采取的措施是使平衡正向进行,结合化学平衡移动原理分析选项;
(4)设平衡时转化的浓度为x,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:x O 0
转化:1.2 0.6 0.6
某时刻:0.9 0.6 0.6
结合平衡常数概念和浓度积常数比较分析计算得到,以此解答该题.
解答:
解:(1)①由图2可知,正、逆反应速率都增大,为升高温度,且逆反应速率增大更多,反应向逆反应进行,故正反应为放热反应,故答案为:放热;
②由图可知,10min到达平衡时二氧化碳的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,所以v(CO2)=
=
mol/(L?min),速率之比等于化学计量数之比,所以v(H2)=3v(CO2)=3×
mol/(L?min)=0.5mol/(L?min),
故答案为:0.5mol/(L?min);
③平衡时二氧化碳的浓度为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
由计算可知,平衡时CH3OH的体积分数ω=
×100%=30%,
故答案为:30%;
(2)B中是等压条件下的反应,等压条件下,气体的物质的量之比等于其体积之比,反应前气体的物质的量是3.6mol,则反应后气体的物质的量=
×3.6mol=5.04mol,根据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)知,参加反应的n(CH3OH)=
=0.72mol,则甲醇的转化率=
×100%=60%;
打开K时,AB组成一个等温等压容器,相应的起始投入总物质的量与平衡的总体积成正比,设打开K重新达到平衡后总的体积为x,则x:(3.6+4.5)=1.4a:4.5,
求得x=2.52a,所以B的体积为2.52a-a=1.52a,
故答案为:60%;1.52a;
(3)一定条件下的密闭容器中,反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H<0
达到平衡时,要提高CO的转化率,可以采取的措施是
A.反应是放热反应,升温平衡逆向进行,CO的转化率减小,故A错误;
B.反应是气体体积减小的反应,加压平衡正向减小,一氧化碳转化率增大,故B正确;
C.增加CO的浓度,一氧化碳转化率减小,故C错误;
D.分离出二甲醚(CH3OCH3),平衡正向进行,一氧化碳转化率增大,故D正确;
E.加入催化剂改变反应速率,不改变化学平衡,一氧化碳转化率不变,故E错误;
故答案为:BD;
(4)设甲醇起始浓度为x,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:x O 0
转化:1.2 0.6 0.6
某时刻 0.9 0.6 0.6
A.CH3OH的起始浓度为x=1.2mol/l+0.9mol/L=2.1mol/L,故A正确;
B.浓度商Q=
=0.44<100,反应未达到平衡,反应正向进行:平衡时CH3OH的浓度小于0.9mol/L,故B错误;
C.浓度商Q=
=0.44<100,反应未达到平衡,反应正向进行,此时正反应速率大于逆反应速率,故C正确;
D.设平衡时生成甲醚的浓度为x,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:2.1 O 0
转化:2x x x
平衡 2.1-2x x x
K=
=100
x=1mol/L
平衡时CH3OH的转化率=
×100%=95.2%,大于80%,故D错误;
故答案为:AC;
②由图可知,10min到达平衡时二氧化碳的浓度变化量为1mol/L-0.5mol/L=0.5mol/L,所以v(CO2)=
| 0.5mol/L |
| 3min |
| 0.5 |
| 3 |
| 0.5 |
| 3 |
故答案为:0.5mol/(L?min);
③平衡时二氧化碳的浓度为0.25mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
由计算可知,平衡时CH3OH的体积分数ω=
| 0.75 |
| 0.25+0.75+0.75+0.75 |
故答案为:30%;
(2)B中是等压条件下的反应,等压条件下,气体的物质的量之比等于其体积之比,反应前气体的物质的量是3.6mol,则反应后气体的物质的量=
| 1.4a |
| a |
| 5.04mol-3.6mol |
| 2 |
| 0.72mol |
| 1.2mol |
打开K时,AB组成一个等温等压容器,相应的起始投入总物质的量与平衡的总体积成正比,设打开K重新达到平衡后总的体积为x,则x:(3.6+4.5)=1.4a:4.5,
求得x=2.52a,所以B的体积为2.52a-a=1.52a,
故答案为:60%;1.52a;
(3)一定条件下的密闭容器中,反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H<0
达到平衡时,要提高CO的转化率,可以采取的措施是
A.反应是放热反应,升温平衡逆向进行,CO的转化率减小,故A错误;
B.反应是气体体积减小的反应,加压平衡正向减小,一氧化碳转化率增大,故B正确;
C.增加CO的浓度,一氧化碳转化率减小,故C错误;
D.分离出二甲醚(CH3OCH3),平衡正向进行,一氧化碳转化率增大,故D正确;
E.加入催化剂改变反应速率,不改变化学平衡,一氧化碳转化率不变,故E错误;
故答案为:BD;
(4)设甲醇起始浓度为x,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:x O 0
转化:1.2 0.6 0.6
某时刻 0.9 0.6 0.6
A.CH3OH的起始浓度为x=1.2mol/l+0.9mol/L=2.1mol/L,故A正确;
B.浓度商Q=
| 0.6×0.6 |
| 0.92 |
C.浓度商Q=
| 0.6×0.6 |
| 0.92 |
D.设平衡时生成甲醚的浓度为x,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始:2.1 O 0
转化:2x x x
平衡 2.1-2x x x
K=
| x2 |
| (2.1-2x)2 |
x=1mol/L
平衡时CH3OH的转化率=
| 2mol/L |
| 2.1mol/L |
故答案为:AC;
点评:本题考查较为综合,涉及反应速率、平衡常数、平衡移动影响因素分析判断,结合恒温、恒压条件下物质的量与体积的关系来分析解答,题目难度中等.

练习册系列答案
相关题目
下列各组物质混合后一定没有氯气生成的是( )
| A、KMnO4,H2SO4,AlCl3 |
| B、NaClO,MgCl2,HNO3 |
| C、NaCl,NaClO4,NaClO3,Na2SO4 |
| D、KClO3,KCl,H2SO4 |
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH-
3H2↑+FeO42-.下列说法正确的是( )
| ||
| A、铁为阳极,H2SO4为电解液 |
| B、铁为阴极,浓NaOH为电解液 |
| C、阳极发生的电极反应为Fe+8OH--6e-═4H2O+FeO42- |
| D、铁失去3 mol电子可以在阴极得到33.6 L氢气 |
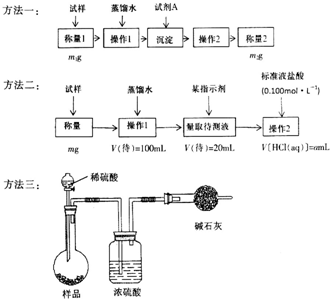 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.