题目内容
实验室对中草药中可能的残余有毒元素砷的测定分析步骤如下(As在中草药中主要以As2O3的形式存在):
①取1kg中草药样品进行前期处理制得100.00mL待测溶液,此时样品中可能含有的砷元素将转化为H3AsO3;
②取25.00mL 待测溶液转入锥形瓶中,并加入2一3滴0.2%的淀粉溶液;
③用标准碘溶液滴定侍测溶液至终点,消耗20.00mL 0.0005mol?L-的标准碘溶液,发生反应:H3AsO3+I2+H2O=H3AsO4+2I-+2H+
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液? .
(2)0.2%的淀粉溶液的作用是:
(3)所用标准碘溶液是由纯KIO3、过量的KI以及稀硫酸混合反应,并将其稀释而制得,该反应的离子方程式为: .
(4)请计算该中草药样品中砷元素的含量为 mg/kg (保留2位小数,不写计算过程).
①取1kg中草药样品进行前期处理制得100.00mL待测溶液,此时样品中可能含有的砷元素将转化为H3AsO3;
②取25.00mL 待测溶液转入锥形瓶中,并加入2一3滴0.2%的淀粉溶液;
③用标准碘溶液滴定侍测溶液至终点,消耗20.00mL 0.0005mol?L-的标准碘溶液,发生反应:H3AsO3+I2+H2O=H3AsO4+2I-+2H+
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
(2)0.2%的淀粉溶液的作用是:
(3)所用标准碘溶液是由纯KIO3、过量的KI以及稀硫酸混合反应,并将其稀释而制得,该反应的离子方程式为:
(4)请计算该中草药样品中砷元素的含量为
考点:探究物质的组成或测量物质的含量,中和滴定
专题:实验探究和数据处理题
分析:(1)类似于海带中碘的提取与检验:取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液;
(2)淀粉在与碘有关的氧化还原滴定中常用作指示剂,反应的变化为:I2→I-,故颜色变化为由蓝色变为无色,且要半分钟不变色;
(3)由于碘单质难溶于水,易于I-络合成I3-而易溶于水,又IO3-有氧化性,I-有强还原性,在酸性条件下发生氧化还原还应,由价态归中,生成I2,再用化合价升降法配平即可;
(4)由多步反应得:As~I2,据此计算1kg药品中As元素的质量,据此计算判断.
(2)淀粉在与碘有关的氧化还原滴定中常用作指示剂,反应的变化为:I2→I-,故颜色变化为由蓝色变为无色,且要半分钟不变色;
(3)由于碘单质难溶于水,易于I-络合成I3-而易溶于水,又IO3-有氧化性,I-有强还原性,在酸性条件下发生氧化还原还应,由价态归中,生成I2,再用化合价升降法配平即可;
(4)由多步反应得:As~I2,据此计算1kg药品中As元素的质量,据此计算判断.
解答:
解:(1)少量的中草药样品进行前期处理制得待测溶液的方法为:取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液;
故答案为:取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液;
(2)淀粉在与碘有关的氧化还原滴定中常用作指示剂,反应的变化为:I2→I-,故颜色变化为由蓝色变为无色,且要半分钟不变色,
故答案为:作为指示剂以判断滴定的终点;溶液由蓝色变为无色,保持半分钟不变色;
(3)由于碘单质难溶于水,易于I-络合成I3-而易溶于水,又IO3-有氧化性,I-有强还原性,在酸性条件下发生氧化还原还应,价态归中,生成I2,再用化合价升降法配平可得:IO3-+5I-+6H+=3I2+3H2O,故答案为:IO3-+5I-+6H+=3I2+3H2O;
(4)由反应定量关系得:As~I2
1 1
n 0.02L×0.0005mol?L-1
n=1×10-5mol
100.00mL待测溶液中含有4×10-5mol,
解得m(As)=0.00004mol×74.9g/mol=0.00300g,则含量为:0.00300g×
=3mg/Kg,
故答案为:3.00.
故答案为:取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液;
(2)淀粉在与碘有关的氧化还原滴定中常用作指示剂,反应的变化为:I2→I-,故颜色变化为由蓝色变为无色,且要半分钟不变色,
故答案为:作为指示剂以判断滴定的终点;溶液由蓝色变为无色,保持半分钟不变色;
(3)由于碘单质难溶于水,易于I-络合成I3-而易溶于水,又IO3-有氧化性,I-有强还原性,在酸性条件下发生氧化还原还应,价态归中,生成I2,再用化合价升降法配平可得:IO3-+5I-+6H+=3I2+3H2O,故答案为:IO3-+5I-+6H+=3I2+3H2O;
(4)由反应定量关系得:As~I2
1 1
n 0.02L×0.0005mol?L-1
n=1×10-5mol
100.00mL待测溶液中含有4×10-5mol,
解得m(As)=0.00004mol×74.9g/mol=0.00300g,则含量为:0.00300g×
| 1000mg |
| 1Kg |
故答案为:3.00.
点评:本题考查氧化还原反应配平与滴定应用等,题目过程比较复杂、题目难度中等,为易错题目,注意利用关系式进行的计算.

练习册系列答案
相关题目
下列说法正确的是( )
| A、C4H8O2的同分异构体中能与NaOH反应的有5种 |
| B、等质量的有机物完全燃烧后生成的CO2的量相同,则这两种有机物的实验式一定相同 |
| C、石蜡油分解的实验中,碎瓷片的作用是催化作用和积蓄热量产生高温 |
| D、将甲烷与氯气的混合气体置于密闭容器中放置光亮的地方,一段时间后,装置内的气体有甲烷、氯气、氯化氢、一氯甲烷,二氯甲烷 |
下列关于物质的检验说法不正确的是( )
| A、向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- |
| B、将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含K+ |
| C、待检液逐滴加入NaOH溶液,有白色胶状沉淀产生后来沉淀逐渐消失,则原溶液中可能含有Al3+ |
| D、待检液中先加入KSCN溶液,无明显现象,再加入氯水溶液显血红色,则待检液中一定含有Fe2+ |
已知室温时,1mol/L某一元弱碱MOH在水中有0.001%发生电离,则该一元弱碱溶液导电能力最接近于( )
| A、1mol/LHNO3溶液 |
| B、水自身电离出C(H+)=10-9mol/L的盐酸 |
| C、pH为6的盐酸 |
| D、1×10-3mol/L NaCl溶液 |
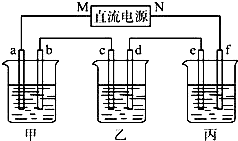 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.