题目内容
已知某温度下CH3COOH和NH3?H2O 的电离常数相等.现向10mL浓度为0.1mol?L?1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,下列说法不正确的是( )
| A、水的电离程度先增大,后又减小 |
| B、c(CH3COOH)与c(CH3COO?)之和始终保持不变 |
| C、溶液导电性先增强后减弱 |
| D、当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大,当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小;
B.根据物料守恒,醋酸和醋酸根离子的物质的量之和不变,但是溶液体积增大,二者的浓度之和逐渐减小;
C.溶液的导电性与溶液中离子浓度有关,醋酸中滴入氨水后,反应生成强电解质醋酸铵,溶液中离子浓度增大;醋酸完全反应后,继续滴入氨水,一水合氨为弱电解质,溶液中离子总浓度减小;
D.CH3COOH和NH3?H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性,根据电荷守恒可知c(NH4+)=c(CH3COO-).
B.根据物料守恒,醋酸和醋酸根离子的物质的量之和不变,但是溶液体积增大,二者的浓度之和逐渐减小;
C.溶液的导电性与溶液中离子浓度有关,醋酸中滴入氨水后,反应生成强电解质醋酸铵,溶液中离子浓度增大;醋酸完全反应后,继续滴入氨水,一水合氨为弱电解质,溶液中离子总浓度减小;
D.CH3COOH和NH3?H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性,根据电荷守恒可知c(NH4+)=c(CH3COO-).
解答:
解:A.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故A正确;
B.n(CH3COOH)与n(CH3COO-)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO-)之和逐渐减小,故B错误;
C.醋酸为弱酸,醋酸中滴入氨水后,反应生成强电解质醋酸铵,溶液中离子浓度增大,溶液导电性增强;醋酸完全反应后,继续滴入氨水,一水合氨为弱电解质,溶液中离子总浓度减小,则溶液导电性逐渐减弱,故C正确;
D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),故D正确;
故选D.
B.n(CH3COOH)与n(CH3COO-)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO-)之和逐渐减小,故B错误;
C.醋酸为弱酸,醋酸中滴入氨水后,反应生成强电解质醋酸铵,溶液中离子浓度增大,溶液导电性增强;醋酸完全反应后,继续滴入氨水,一水合氨为弱电解质,溶液中离子总浓度减小,则溶液导电性逐渐减弱,故C正确;
D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),故D正确;
故选D.
点评:本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确根据电荷守恒、物料守恒、盐的水解比较溶液中离子浓度大小的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH-
3H2↑+FeO42-.下列说法正确的是( )
| ||
| A、铁为阳极,H2SO4为电解液 |
| B、铁为阴极,浓NaOH为电解液 |
| C、阳极发生的电极反应为Fe+8OH--6e-═4H2O+FeO42- |
| D、铁失去3 mol电子可以在阴极得到33.6 L氢气 |
已知室温时,1mol/L某一元弱碱MOH在水中有0.001%发生电离,则该一元弱碱溶液导电能力最接近于( )
| A、1mol/LHNO3溶液 |
| B、水自身电离出C(H+)=10-9mol/L的盐酸 |
| C、pH为6的盐酸 |
| D、1×10-3mol/L NaCl溶液 |
检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2═I2+2H2O,下列对该反应的叙述中不正确的( )
| A、I2为氧化产物 |
| B、H2O2既作氧化剂又作还原剂 |
| C、氧化性强弱顺序为H2O2>I2 |
| D、生成1 mol I2时转移2 mol电子 |
 ,③CH3CH2OH,④CH3COOH,⑤聚乙烯五种物质中:
,③CH3CH2OH,④CH3COOH,⑤聚乙烯五种物质中: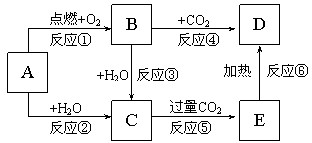 如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
如图所示,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.