题目内容
已知反应A2(g)+2B2(g)?2AB2(g)+Q的Q>0,下列说法正确的是( )
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度有利于该反应平衡正向移动 |
| D、达到平衡后,减小压强有利于该反应平衡正向移动 |
考点:化学平衡的影响因素,化学反应速率的影响因素
专题:
分析:A.升温正逆反应速率都增大;
B.升高温度,反应速率加快;
C.升高温度平衡向吸热反应方向移动;
D.减小压强,平衡向气体体积增大的方向移动.
B.升高温度,反应速率加快;
C.升高温度平衡向吸热反应方向移动;
D.减小压强,平衡向气体体积增大的方向移动.
解答:
解:A.升温正逆反应速率都增大,故A错误;
B.升高温度,反应速率加快,缩短到达平衡的时间,故B正确;
C.正反应为放热反应,升高温度平衡向吸热反应方向移动,即向逆反应方向移动,故C错误;
D.正反应为气体题减小的反应,减小压强,平衡向气体体积增大的方向移动,即向逆反应方向移动,故D错误,
故选B.
B.升高温度,反应速率加快,缩短到达平衡的时间,故B正确;
C.正反应为放热反应,升高温度平衡向吸热反应方向移动,即向逆反应方向移动,故C错误;
D.正反应为气体题减小的反应,减小压强,平衡向气体体积增大的方向移动,即向逆反应方向移动,故D错误,
故选B.
点评:本题考查化学平衡的影响因素,比较基础,注意对平衡移动原理的理解及应用.

练习册系列答案
相关题目
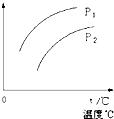 在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )| A、P1>P2,纵坐标指Y的质量分数 |
| B、P1<P2,纵坐标指X的转化率 |
| C、P1>P2,纵坐标指Z的质量分数 |
| D、P1<P2,纵坐标指混合气体的平均摩尔质量 |
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A、若生成1 mol Fe,则吸收的热量小于a kJ |
| B、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| C、若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 |
| D、达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
生铁的熔点是1100℃~1200℃,则纯铁的熔点可能是( )
| A、1055℃ |
| B、1100℃ |
| C、1200℃ |
| D、1535℃ |
已知反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O下列说法正确的是( )
| A、Cl2既是氧化剂也是还原剂 |
| B、该反应中的电子转移数目为6e- |
| C、氧化剂和还原剂的质量比是1:5 |
| D、NaCl是氧化产物,NaClO3是还原产物 |
某温度时,Kw=1×10-12,下列说法正确的是( )
| A、pH=2的盐酸和pH=12的NaOH溶液等体积混合后,溶液的pH=7 | ||
| B、pH=11的氨水中c(OH-)=0.1mol?L-1 | ||
C、向盐酸中滴加氨水至溶液的pH=6,所得溶液中c(Cl-)>c(N
| ||
| D、将pH=4.5的盐酸稀释100倍后,溶液的pH=6.5 |
下列有关卤素及其化合物的递变规的描述中,错误的是( )
| A、原子半径:F<Cl<Br<I |
| B、熔点:F2<Cl2<Br2<I2 |
| C、氧化性:F2>Cl2>Br2>I2 |
| D、还原性:F->Cl->Br->I- |
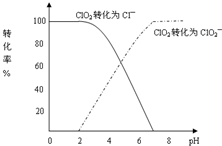 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定: