题目内容
粉末试样A是由等物质的量的MgO和Fe2O3组成的混合物.现进行如下试验:
①将适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L 6.0mol/L盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体,同时生成溶液D,还残留有固体B;
④用KSCN溶液检验时,溶液D不变色.
(1)①中引发铝热反应的试验操作是
(2)若溶液D的体积为0.15L,则溶液中c(Mg2+)为 mol/L; c(Fe2+)为 mol/L.
①将适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L 6.0mol/L盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体,同时生成溶液D,还残留有固体B;
④用KSCN溶液检验时,溶液D不变色.
(1)①中引发铝热反应的试验操作是
(2)若溶液D的体积为0.15L,则溶液中c(Mg2+)为
考点:有关混合物反应的计算,镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:①铝热反应本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁;
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水;
③放出1.12L(标准状况)气体,说明生成氢气,溶液C为氯化铁、氯化镁、盐酸的混合溶液,Fe和溶液C反应为:Fe与盐酸反应生成氯化亚铁与氢气,铁与氯化铁反应生成氯化亚铁;
④用KSCN溶液检验时,溶液D不变色,说明不含铁离子;
(1)引发铝热反应,可加入少量氯酸钾,插上镁条点燃;
(2)令MgO和Fe2O3的物质的量分别为xmol,根据二者质量计算x的值,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO),再根据c=nV计算镁离子浓度,根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),据此计算亚铁离子浓度.
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水;
③放出1.12L(标准状况)气体,说明生成氢气,溶液C为氯化铁、氯化镁、盐酸的混合溶液,Fe和溶液C反应为:Fe与盐酸反应生成氯化亚铁与氢气,铁与氯化铁反应生成氯化亚铁;
④用KSCN溶液检验时,溶液D不变色,说明不含铁离子;
(1)引发铝热反应,可加入少量氯酸钾,插上镁条点燃;
(2)令MgO和Fe2O3的物质的量分别为xmol,根据二者质量计算x的值,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO),再根据c=nV计算镁离子浓度,根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),据此计算亚铁离子浓度.
解答:
解:①铝热反应本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁;
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水;
③放出1.12L(标准状况)气体,说明生成氢气,溶液C为氯化铁、氯化镁、盐酸的混合溶液,Fe和溶液C反应为:Fe与盐酸反应生成氯化亚铁与氢气,铁与氯化铁反应生成氯化亚铁;
④用KSCN溶液检验时,溶液D不变色,说明不含铁离子;
(1)铝热反应需在高温条件下进行,引发铝热反应,可加入少量氯酸钾,插上镁条点燃,故答案为:加少量氯酸钾,插上镁条点燃;
(2)令MgO和Fe2O3的物质的量分别为xmol,则40x+160x=20,解得x=0.1,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO)=0.1mol,所以c(Mg2+)=
=0.67mol/L;根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),所以2×0.67mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.33mol/L,
故答案为:0.67;2.33.
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水;
③放出1.12L(标准状况)气体,说明生成氢气,溶液C为氯化铁、氯化镁、盐酸的混合溶液,Fe和溶液C反应为:Fe与盐酸反应生成氯化亚铁与氢气,铁与氯化铁反应生成氯化亚铁;
④用KSCN溶液检验时,溶液D不变色,说明不含铁离子;
(1)铝热反应需在高温条件下进行,引发铝热反应,可加入少量氯酸钾,插上镁条点燃,故答案为:加少量氯酸钾,插上镁条点燃;
(2)令MgO和Fe2O3的物质的量分别为xmol,则40x+160x=20,解得x=0.1,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO)=0.1mol,所以c(Mg2+)=
| 0.1mol |
| 0.15L |
故答案为:0.67;2.33.
点评:本题考查铝热反应,混合物的计算等,为高频考点,难度中等,理解反应过程是解题的关键,注意(2)利用电荷守恒计算比过程计算法要简单.

练习册系列答案
相关题目
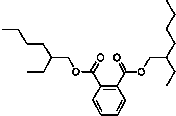 受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )
受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )| A、DEHP是芳香族化合物 |
| B、DEHP是酯类物质 |
| C、DEHP分子中共有5个双键 |
| D、DEHP分子中至少有8个碳原子在同一平面 |
用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )


| A、22.3mL |
| B、22.30mL |
| C、23.65mL |
| D、23.4 mL |
已知反应A2(g)+2B2(g)?2AB2(g)+Q的Q>0,下列说法正确的是( )
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度有利于该反应平衡正向移动 |
| D、达到平衡后,减小压强有利于该反应平衡正向移动 |
有些科学家提出硅是“21世纪的能源”.下列关于硅的说法不正确的是( )
| A、高纯度的单质硅被广泛用于制作计算机芯片、制造太阳能电池 |
| B、硅可由二氧化硅还原制得 |
| C、常温时硅与水、空气和酸不反应,但能与氢氟酸反应 |
| D、自然界硅元素的贮量丰富,并存在大量的单质硅 |

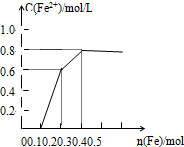 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.