题目内容
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A、若生成1 mol Fe,则吸收的热量小于a kJ |
| B、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| C、若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 |
| D、达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
考点:化学平衡状态的判断,化学平衡的计算,浓度、温度、催化剂对化学反应速率的影响
专题:
分析:A.根据方程式知,若生成1mol铁需要吸收akJ热量;
B.该反应的反应前后气体计量数不变,所以无论该反应是否达到平衡状态,压强不变;
C.升高温度,正逆反应速率都增大,平衡向吸热反应方向移动;
D.达到平衡状态时,若c(CO)=0.100 mol/L,根据K=
计算c(CO2).
B.该反应的反应前后气体计量数不变,所以无论该反应是否达到平衡状态,压强不变;
C.升高温度,正逆反应速率都增大,平衡向吸热反应方向移动;
D.达到平衡状态时,若c(CO)=0.100 mol/L,根据K=
| c(CO2) |
| c(CO) |
解答:
解:A.根据方程式知,若生成1mol铁需要吸收akJ热量,而不是小于akJ/mol,故A错误;
B.该反应的反应前后气体计量数不变,所以无论该反应是否达到平衡状态,压强不变,则不能根据压强判断平衡状态,故B错误;
C.升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,即向正反应方向移动,故C错误;
D.达到平衡状态时,若c(CO)=0.100 mol/L,根据K=
得c(CO2)=Kc(CO)=0.263×0.100 mol/L=0.0263 mol/L,故D正确;
故选D.
B.该反应的反应前后气体计量数不变,所以无论该反应是否达到平衡状态,压强不变,则不能根据压强判断平衡状态,故B错误;
C.升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,即向正反应方向移动,故C错误;
D.达到平衡状态时,若c(CO)=0.100 mol/L,根据K=
| c(CO2) |
| c(CO) |
故选D.
点评:本题考查平衡常数的计算、化学平衡状态的判断、反应速率及化学平衡的影响因素等知识点,侧重考查分析、计算能力,注意该反应特点,能根据平衡常数进行有关计算,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
用0.1026mol?L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )


| A、22.3mL |
| B、22.30mL |
| C、23.65mL |
| D、23.4 mL |
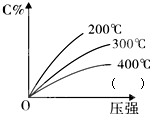 可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度和压强的关系如图,下列叙述正确的是( )
可逆反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度和压强的关系如图,下列叙述正确的是( )| A、达平衡后,加入催化剂则C%增大 |
| B、达平衡后,若升温,平衡右移 |
| C、达平衡后,增加A的量有利于平衡向右移动 |
| D、化学方程式中n>e+f |
已知反应A2(g)+2B2(g)?2AB2(g)+Q的Q>0,下列说法正确的是( )
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度有利于该反应平衡正向移动 |
| D、达到平衡后,减小压强有利于该反应平衡正向移动 |
将充有mmLNO和nmLNO2的量筒倒立于水槽中,然后通入mmLO2,若m<n,则充分反应后量筒内气体体积(mL)为( )
| A、3(m-n) | ||
B、
| ||
C、
| ||
D、
|
下表是五种银盐的溶度积常数(25℃):下列说法错误的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A、五种物质在常温下溶解度最大的是Ag2SO4 |
| B、将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀 |
| C、AgCl、AgBr和AgI三种物质在常温下的溶解度随着氯、溴、碘的顺序增大 |
| D、沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |


 该分子中最多有
该分子中最多有 ,这三种单体的结构简式分别是
,这三种单体的结构简式分别是