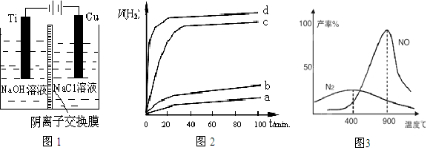
题目内容
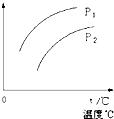 在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )| A、P1>P2,纵坐标指Y的质量分数 |
| B、P1<P2,纵坐标指X的转化率 |
| C、P1>P2,纵坐标指Z的质量分数 |
| D、P1<P2,纵坐标指混合气体的平均摩尔质量 |
考点:转化率随温度、压强的变化曲线,产物百分含量与压强的关系曲线
专题:
分析:该反应是一个反应前后气体体积减小、吸热的可逆反应,
A.相同温度下,如果P1>P2,增大压强,平衡向正反应方向移动,则Y的质量分数减小;
B.相同温度下,如果P1<P2,增大压强,平衡向正反应方向移动,则X的转化率增大;
C.相同温度下,如果P1>P2,增大压强,平衡向正反应方向移动,则Z的质量分数增大;
D.相同温度下,如果P1<P2,增大压强,平衡向正反应方向移动,则混合气体的物质的量减小,混合气体的质量不变,则混合气体的平均摩尔质量增大.
A.相同温度下,如果P1>P2,增大压强,平衡向正反应方向移动,则Y的质量分数减小;
B.相同温度下,如果P1<P2,增大压强,平衡向正反应方向移动,则X的转化率增大;
C.相同温度下,如果P1>P2,增大压强,平衡向正反应方向移动,则Z的质量分数增大;
D.相同温度下,如果P1<P2,增大压强,平衡向正反应方向移动,则混合气体的物质的量减小,混合气体的质量不变,则混合气体的平均摩尔质量增大.
解答:
解:该反应是一个反应前后气体体积减小、吸热的可逆反应,
A.相同温度下,如果P1>P2,增大压强,平衡向正反应方向移动,则Y的质量分数减小,所以P1曲线应该在P2的下方,且升高温度平衡向正反应方向移动,则Y的质量分数减小,所以曲线应该随着X轴逐渐减小,故A错误;
B.相同温度下,如果P1<P2,增大压强,平衡向正反应方向移动,则X的转化率增大,则P1曲线应该在P2的下方,且升高温度平衡向正反应方向移动,则X的转化率增大,故B错误;
C.相同温度下,如果P1>P2,增大压强,平衡向正反应方向移动,则Z的质量分数增大,则P1曲线在P2的上方,且升高温度平衡向正反应方向移动,则Z的质量分数增大,故C正确;
D.相同温度下,如果P1<P2,增大压强,平衡向正反应方向移动,则混合气体的物质的量减小,混合气体的质量不变,则混合气体的平均摩尔质量增大,所以P1曲线应该在P2的下方,且升高温度平衡向正反应方向移动,则混合气体的平均摩尔质量增大,故D错误;
故选C.
A.相同温度下,如果P1>P2,增大压强,平衡向正反应方向移动,则Y的质量分数减小,所以P1曲线应该在P2的下方,且升高温度平衡向正反应方向移动,则Y的质量分数减小,所以曲线应该随着X轴逐渐减小,故A错误;
B.相同温度下,如果P1<P2,增大压强,平衡向正反应方向移动,则X的转化率增大,则P1曲线应该在P2的下方,且升高温度平衡向正反应方向移动,则X的转化率增大,故B错误;
C.相同温度下,如果P1>P2,增大压强,平衡向正反应方向移动,则Z的质量分数增大,则P1曲线在P2的上方,且升高温度平衡向正反应方向移动,则Z的质量分数增大,故C正确;
D.相同温度下,如果P1<P2,增大压强,平衡向正反应方向移动,则混合气体的物质的量减小,混合气体的质量不变,则混合气体的平均摩尔质量增大,所以P1曲线应该在P2的下方,且升高温度平衡向正反应方向移动,则混合气体的平均摩尔质量增大,故D错误;
故选C.
点评:本题考查温度、压强对可逆反应平衡移动的影响,侧重考查分析能力,结合可逆反应特点采用“定一议二”的方法分析解答,题目难度中等.

练习册系列答案
相关题目
已知反应A2(g)+2B2(g)?2AB2(g)+Q的Q>0,下列说法正确的是( )
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度有利于该反应平衡正向移动 |
| D、达到平衡后,减小压强有利于该反应平衡正向移动 |
等物质量浓度的FeBr3和CuCl2的混合溶液用惰性电极电解最初在负极发生反应的离子是( )
| A、Fe3+ |
| B、Br- |
| C、Cu2+ |
| D、Cl- |
将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到的气体与O2(标准状况)混合溶于水恰好全部转化为硝酸.则所消耗O2的体积是( )
| A、336ml |
| B、224 ml |
| C、448 ml |
| D、112 ml |

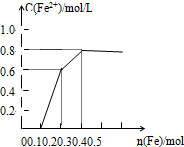 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.