题目内容
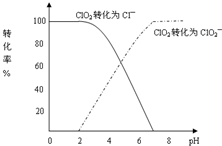 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2═Na2S4O6+2NaI
①请写出pH≤2.0时,CIO2-与I-反应的离子方程式
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中.
步骤2:调节水样的pH为7.0~8.0.
步骤3:加入足量的K I晶体.
步骤4:加少量淀粉溶液,用c mol?L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL.
步骤5:
步骤6:再用c mol?L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为
④根据上述分析数据,测得该饮用水样中CIO2-的浓度为
⑤若饮用水中ClO2- 的含量超标,可向其中加入适量的Fe2+将ClO2- 还原成Cl--,请猜测该反应的氧化产物是
考点:探究物质的组成或测量物质的含量,氧化还原反应,中和滴定
专题:实验探究和数据处理题
分析:(1)根据题意ClO2-与I-反应在酸性条件进行,产物为I2和Cl-,根据质量守恒可写出离子方程式;
(2)题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合pH≤2.0时,ClO2-与I-反应的离子方程式可判断出调节溶液的pH≤2.0;
(3)单质碘遇淀粉变蓝,当单质碘和Na2S2O3溶液完全反应,没有单质碘,则蓝色消失;
(4)求饮用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系;
(5)Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,结合反应物不难得出答案.
(2)题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合pH≤2.0时,ClO2-与I-反应的离子方程式可判断出调节溶液的pH≤2.0;
(3)单质碘遇淀粉变蓝,当单质碘和Na2S2O3溶液完全反应,没有单质碘,则蓝色消失;
(4)求饮用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系;
(5)Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,结合反应物不难得出答案.
解答:
解:(1)ClO2-与I-反应在酸性条件进行,产物为I2和Cl-,根据质量守恒可写出离子方程式为:ClO2-+4H++4I-=Cl-+2I2+2H2O,
故答案为:ClO2-+4H++4I-=Cl-+2I2+2H2O;
(2)根据曲线图示在pH≤2.0时,ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量,故答案为:调节溶液的pH≤2.0;
(3)单质碘遇淀粉变蓝,当单质碘和Na2S2O3溶液完全反应,即达到滴定终点,没有单质碘,则蓝色消失,
故答案为:锥形瓶内颜色由蓝色变为无色,且半分钟不复原;
(4)由 2ClO2+2I-→2ClO2-+I2 和2Na2S2O3+I2=Na2S4O6+2NaI
得:ClO2-~Na2S2O3
1 1
n(ClO2-)
则n(ClO2-)=
由ClO2-+4H++4I-=Cl-+2I2+2H2O 和2Na2S2O3+I2=Na2S4O6+2NaI
得:ClO2-~4Na2S2O3
1 4
n(ClO2-)总
n(ClO2-)总=
×
原水样中ClO2-浓度=
,
故答案为:
;
(5)根据反应:12Fe2++3ClO2-+6H2O═8Fe3++4Fe(OH)3+3Cl-,所以氧化产物为Fe(OH)3(FeCl3),故答案为:Fe(OH)3(FeCl3).
故答案为:ClO2-+4H++4I-=Cl-+2I2+2H2O;
(2)根据曲线图示在pH≤2.0时,ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量,故答案为:调节溶液的pH≤2.0;
(3)单质碘遇淀粉变蓝,当单质碘和Na2S2O3溶液完全反应,即达到滴定终点,没有单质碘,则蓝色消失,
故答案为:锥形瓶内颜色由蓝色变为无色,且半分钟不复原;
(4)由 2ClO2+2I-→2ClO2-+I2 和2Na2S2O3+I2=Na2S4O6+2NaI
得:ClO2-~Na2S2O3
1 1
n(ClO2-)
| cV1 |
| 1000 |
则n(ClO2-)=
| cV1 |
| 1000 |
由ClO2-+4H++4I-=Cl-+2I2+2H2O 和2Na2S2O3+I2=Na2S4O6+2NaI
得:ClO2-~4Na2S2O3
1 4
n(ClO2-)总
| cV2 |
| 1000 |
n(ClO2-)总=
| 1 |
| 4 |
| cV2 |
| 1000 |
原水样中ClO2-浓度=
| c(V2-4V1) |
| 4V |
故答案为:
| c(V2-4V1) |
| 4V |
(5)根据反应:12Fe2++3ClO2-+6H2O═8Fe3++4Fe(OH)3+3Cl-,所以氧化产物为Fe(OH)3(FeCl3),故答案为:Fe(OH)3(FeCl3).
点评:关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
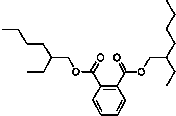 受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )
受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )| A、DEHP是芳香族化合物 |
| B、DEHP是酯类物质 |
| C、DEHP分子中共有5个双键 |
| D、DEHP分子中至少有8个碳原子在同一平面 |
已知反应A2(g)+2B2(g)?2AB2(g)+Q的Q>0,下列说法正确的是( )
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度有利于该反应平衡正向移动 |
| D、达到平衡后,减小压强有利于该反应平衡正向移动 |


 该分子中最多有
该分子中最多有 ,这三种单体的结构简式分别是
,这三种单体的结构简式分别是