题目内容
17.下列每项中的三对物质都能用分液漏斗进行分离的是( )| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 乙酸和水、甲苯和水、己烷和水 |
分析 都能用分液漏斗进行分离,则混合物出现分层,结合物质的溶解性来解答.
解答 解:A.酒精和水互溶不分层,不能利用分液漏斗分离,故A错误;
B.均分层,都能用分液漏斗进行分离,故B正确;
C.均不分层,都不能用分液漏斗进行分离,故C错误;
D.乙酸和水不分层,不能用分液漏斗进行分离,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高考常见题型,侧重于学生的分析、实验能力的考查,把握物质的性质、混合物分离提纯实验仪器为解答的关键,题目难度不大.

练习册系列答案
相关题目
7.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤(NH4)2CO3.
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤(NH4)2CO3.
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑤ | D. | 全部 |
8.25℃时,在浓度为1mol•L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为mol•L-1).下列判断正确的是( )
| A. | a=b=c | B. | a>b>c | C. | a>c>b | D. | c>a>b |
12.下列说法正确的是( )
| A. | 增加反应物的用量一定能增大反应速率 | |
| B. | 化学反应速率只能加快不能减慢 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 参加反应物质的性质是决定化学反应速率的主要因素 |
2.已知下列热化学方程式:
(l) C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=△H1
(2)2H2(g)+O2(g)=2H2O(g)△H=△H2
由此可知 C(s)+H2O(g)═CO(g)+H2(g)△H3.则△H3等于( )
(l) C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=△H1
(2)2H2(g)+O2(g)=2H2O(g)△H=△H2
由此可知 C(s)+H2O(g)═CO(g)+H2(g)△H3.则△H3等于( )
| A. | △H1-△H2 | B. | △H1-$\frac{1}{2}$△H2 | C. | 2△H1-△H2 | D. | $\frac{1}{2}$△H2-△H1 |
9. 将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )
将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )
 将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )
将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )| A. | 电解过程中阳极区发生如下反应:S2--2e-=S,(n-l)S+S2-=Sn2- | |
| B. | 电解时阴极的电极反应式:2H20+2e-═H2↑+20H- | |
| C. | 电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成Sn2-+2H+═nS↓+H2↑ | |
| D. | 该装置的离子交换膜为阳离子交换膜 |
11.下表列出了①~⑩九种元素在周期表的位置:
(1)写出①③④⑨的元素符号Na、Mg、Al、S.
(2)写出⑦单质的化学式Cl2.灼烧②的化合物,透过蓝色钴玻璃可看见火焰呈紫色,
(3)写出①单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)元素⑥的质子数为8,其原子核外有2个电子层.最外层电子数为6.
(5)元素④与⑥形成化合物的化学式为Al2O3,该化合物与盐酸反应的离子方程式为
Al2O3+6H+=2Al3++3H2O.
(6)单质⑦与石灰乳Ca(OH)2 反应可制得漂白粉,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.漂白粉的有效成分为Ca(ClO)2.
(7)元素⑩的气态氢化物的化学式为NH3,其水溶液呈碱性,实验室制取该物质的化学方程式为2NH4Cl+Ca(OH)2=CaCl2+NH3↑+2H2O.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑩ | ⑥ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | ⑦ | ||
| 4 | ② |
(2)写出⑦单质的化学式Cl2.灼烧②的化合物,透过蓝色钴玻璃可看见火焰呈紫色,
(3)写出①单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)元素⑥的质子数为8,其原子核外有2个电子层.最外层电子数为6.
(5)元素④与⑥形成化合物的化学式为Al2O3,该化合物与盐酸反应的离子方程式为
Al2O3+6H+=2Al3++3H2O.
(6)单质⑦与石灰乳Ca(OH)2 反应可制得漂白粉,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.漂白粉的有效成分为Ca(ClO)2.
(7)元素⑩的气态氢化物的化学式为NH3,其水溶液呈碱性,实验室制取该物质的化学方程式为2NH4Cl+Ca(OH)2=CaCl2+NH3↑+2H2O.
 已知相邻的短周期元素A、B、C、D原子核外共有56个电子,在周期表中的位置如图所示.请画出C原子和A离子的结构示意图:
已知相邻的短周期元素A、B、C、D原子核外共有56个电子,在周期表中的位置如图所示.请画出C原子和A离子的结构示意图: 、
、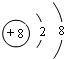 .
.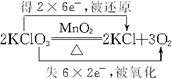 .
.
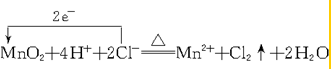 .
.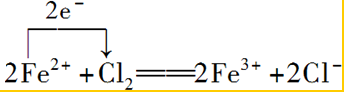 .
.