题目内容
12.下列说法正确的是( )| A. | 增加反应物的用量一定能增大反应速率 | |
| B. | 化学反应速率只能加快不能减慢 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 参加反应物质的性质是决定化学反应速率的主要因素 |
分析 影响化学反应速率的因素有内因和外因,内因为主要因素,是物质的本身性质,而外界因素有浓度、温度、压强以及催化剂等,一般来说增大浓度、升高温度、加入催化剂等,可增大反应速率,以此解答.
解答 解:A.如为固体或纯液体,则增加反应物的用量,浓度不变,故A错误;
B.如降低温度、浓度,可减小反应速率,故B错误;
C.决定化学反应速率的主要因素是物质的本身性质,故C错误;
D.物质的本身性质为影响化学反应速率的主要因素,如钠可与冷水发生剧烈反应,但铜在高温下与水也不反应,故D正确.
故选D.
点评 本题考查化学反应速率知识,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
2.在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO2+2H2S═3S+2H2O | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HCl═NaCl+H2O |
20.下列说法中正确的是( )
| A. | NH4Cl中含有共价键,又全部由非金属元素组成,属于共价化合物 | |
| B. | 氮气和氦气都是非金属单质,都不存在化学键 | |
| C. | H2O2和Na2O2 都属于氧化物,两种物质中所含的化学键的类型完全相同 | |
| D. | KOH中既含有离子键也含有共价键,属于离子化合物 |
7.下列属于吸热反应的是( )
| A. | 铝与盐酸反应 | B. | Ba(OH)2?8H2O和NH4Cl固体反应 | ||
| C. | 盐酸和氢氧化钠的中和反应 | D. | 氢气的燃烧反应 |
17.下列每项中的三对物质都能用分液漏斗进行分离的是( )
| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 乙酸和水、甲苯和水、己烷和水 |
1.硫铁矿(主要成分为FeS2)又称愚人金,用如图所示装置定量测定其硫元素的质量分数.取m g该样品于装置A中,经充分锻烧反应,使硫元素全部转化为氧化物,用B装置完全吸收;将煅烧后A中固体用盐酸溶解得溶液W,经检验W中含有Fe2+和Fe3+.计算硫元素的质量分数还应测量的数据是( )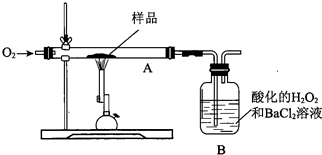

| A. | 测B中沉淀质量 | B. | 测锻烧后A中固体的质量 | ||
| C. | 测B吸收瓶反应前的质量 | D. | 将W蒸干、灼烧,测所得固体质量 |
6.下列说法正确的是( )
| A. | 2g氦气所含原子数为NA | |
| B. | 1molD2O所含电子数为12NA | |
| C. | 0.1mol单质铝与足量盐酸反应转移的电子数为0.3NA | |
| D. | 标准状况下,1L水所含分子数为NA |
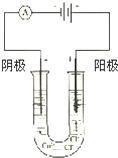 按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.
按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.