题目内容
9. 将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )
将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )| A. | 电解过程中阳极区发生如下反应:S2--2e-=S,(n-l)S+S2-=Sn2- | |
| B. | 电解时阴极的电极反应式:2H20+2e-═H2↑+20H- | |
| C. | 电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成Sn2-+2H+═nS↓+H2↑ | |
| D. | 该装置的离子交换膜为阳离子交换膜 |
分析 电解过程中阳极区发生氧化反应,得到硫单质,然后是硫单质和硫离子之间的反应;阴极上氢离子放电生成氢气,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S,句电解池的工作原理来回答.
解答 解:A、电解过程中阳极区发生氧化反应,得到硫单质,然后是硫单质和硫离子之间的反应,即S2--2e-=S,(n-l)S+S2-=Sn2-,故A正确;
B、电解过程中阴极上氢离子放电生成氢气,2H20+2e-═H2↑+20H-,故B正确;
C、电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故C错误;
D、为了实现H2S转化为S的目的,电解后阳极区离子为Sn2-,酸性条件下,生成S单质、H2S,所以该装置的离子交换膜为阳离子交换膜,故D正确.
故选C.
点评 本题以S为载体考查了可逆反应、氧化还原反应、电解原理等知识点,本题是一道综合题,难度中等,考查了学生运用知识解决问题的能力.

练习册系列答案
相关题目
20.下列说法中正确的是( )
| A. | NH4Cl中含有共价键,又全部由非金属元素组成,属于共价化合物 | |
| B. | 氮气和氦气都是非金属单质,都不存在化学键 | |
| C. | H2O2和Na2O2 都属于氧化物,两种物质中所含的化学键的类型完全相同 | |
| D. | KOH中既含有离子键也含有共价键,属于离子化合物 |
17.下列每项中的三对物质都能用分液漏斗进行分离的是( )
| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 乙酸和水、甲苯和水、己烷和水 |
14.实验室从含碘废液中测定I-的含量以及碘的回收过程如下:
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2mol•L-1 H2SO4溶液和10mL 20% NH4Fe(SO4)2•12H2O溶液,摇匀,小火加热蒸发至碘完全挥发,取下锥形瓶冷却后,加入10mL 2mol•L-1 H2SO4溶液,加入几滴二苯胺磺酸钠(用作指示剂),用0.025 0mol•L-1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录见下表:(已知反应:
①2Fe3++2I-═2Fe2++I2 ②6Fe2++Cr2O${\;}_{7}^{2-}$+14H+═6Fe3++2Cr3++7H2O)
Ⅱ.碘的回收
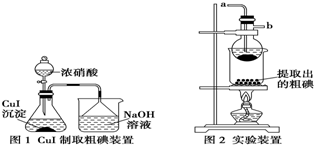
取250mL含碘废液于烧杯中,加入Na2S2O3溶液,并将饱和CuSO4溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应生成CuI沉淀.过滤,得到的CuI沉淀按图1进行操作,检查装置的气密性后,从分液漏斗中逐滴加浓硝酸(注意滴液的速度),完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液,然后按图2进行粗碘的提纯.
请回答下列问题:
(1)简述图2实验装置中烧瓶的作用升华分离冷凝回收碘.
(2)某同学欲配制200mL 2mol•L-1的H2SO4,配制方法合理的是C.
A.在200mL 1mol•L-1的H2SO4中加入22.4L标准状况下的SO3
B.向100mL 4mol•L-1的H2SO4中加入100mL水
C.取5mol•L-1的H2SO4 80.0mL,加水至200mL
D.将16g NaOH固体加入到200mL 3mol•L-1的H2SO4溶液中
(3)在盛有废液的锥形瓶中先加入5mL 2mol•L-1H2SO4的目的是加热蒸发碘时可有效抑制Fe3+水解,使后续测定结果更准确.
(4)根据滴定的有关数据,计算该废液中I-的含量为14.94g•L-1(保留小数点后两位).
(5)写出图1锥形瓶中发生反应的化学方程式:2CuI+8HNO3=2Cu(NO3)2+NO2↑+I2+4H2O.
(6)按图2装置进行粗碘提纯,采用的分离方法是升华,a、b为冷凝水进出口,其中a(填“a”或“b”)接水龙头,最终能得到较多较高纯度的单质碘.
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2mol•L-1 H2SO4溶液和10mL 20% NH4Fe(SO4)2•12H2O溶液,摇匀,小火加热蒸发至碘完全挥发,取下锥形瓶冷却后,加入10mL 2mol•L-1 H2SO4溶液,加入几滴二苯胺磺酸钠(用作指示剂),用0.025 0mol•L-1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录见下表:(已知反应:
①2Fe3++2I-═2Fe2++I2 ②6Fe2++Cr2O${\;}_{7}^{2-}$+14H+═6Fe3++2Cr3++7H2O)
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.60 | 19.65 | 19.55 |
取250mL含碘废液于烧杯中,加入Na2S2O3溶液,并将饱和CuSO4溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应生成CuI沉淀.过滤,得到的CuI沉淀按图1进行操作,检查装置的气密性后,从分液漏斗中逐滴加浓硝酸(注意滴液的速度),完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液,然后按图2进行粗碘的提纯.

请回答下列问题:
(1)简述图2实验装置中烧瓶的作用升华分离冷凝回收碘.
(2)某同学欲配制200mL 2mol•L-1的H2SO4,配制方法合理的是C.
A.在200mL 1mol•L-1的H2SO4中加入22.4L标准状况下的SO3
B.向100mL 4mol•L-1的H2SO4中加入100mL水
C.取5mol•L-1的H2SO4 80.0mL,加水至200mL
D.将16g NaOH固体加入到200mL 3mol•L-1的H2SO4溶液中
(3)在盛有废液的锥形瓶中先加入5mL 2mol•L-1H2SO4的目的是加热蒸发碘时可有效抑制Fe3+水解,使后续测定结果更准确.
(4)根据滴定的有关数据,计算该废液中I-的含量为14.94g•L-1(保留小数点后两位).
(5)写出图1锥形瓶中发生反应的化学方程式:2CuI+8HNO3=2Cu(NO3)2+NO2↑+I2+4H2O.
(6)按图2装置进行粗碘提纯,采用的分离方法是升华,a、b为冷凝水进出口,其中a(填“a”或“b”)接水龙头,最终能得到较多较高纯度的单质碘.
1.硫铁矿(主要成分为FeS2)又称愚人金,用如图所示装置定量测定其硫元素的质量分数.取m g该样品于装置A中,经充分锻烧反应,使硫元素全部转化为氧化物,用B装置完全吸收;将煅烧后A中固体用盐酸溶解得溶液W,经检验W中含有Fe2+和Fe3+.计算硫元素的质量分数还应测量的数据是( )

| A. | 测B中沉淀质量 | B. | 测锻烧后A中固体的质量 | ||
| C. | 测B吸收瓶反应前的质量 | D. | 将W蒸干、灼烧,测所得固体质量 |
18.下列对有机物的命名中,正确的是( )
| A. |  2-甲基丙醇 2-甲基丙醇 | B. |  邻甲基苯酚 邻甲基苯酚 | ||
| C. | CH3CH2OOCCH3 丙酸甲酯 | D. |  2-甲基丙酸 2-甲基丙酸 |
 按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.
按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象. 某物质只含C,H,O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等):
某物质只含C,H,O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等):