题目内容
6.(1)写出下列反应的化学方程式,用双线桥标明电子转移的方向和数目,并注明“被氧化”、“被还原”.①KClO3和MnO2在高温共热条件下反应:
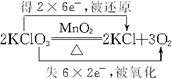 .
.②H2S气体和SO2气体反应生成S和H2O:

(2)写出下列反应的离子方程式,并用单线桥标明电子转移的方向和数目.
实验室制Cl2的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O:
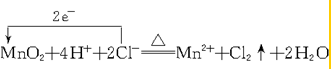 .
.②向FeCl2溶液中通入Cl2生成FeCl3:
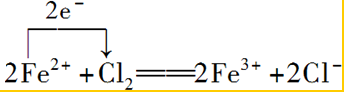 .
.
分析 (1)①氯酸钾分解生成KCl和氧气,该反应中Cl元素化合价由+5价变为0价、O元素化合价由-2价变为0价,结合氧化还原反应的电子转移知识分析;
②该反应中S元素化合价由+4价变为0价、S元素化合价由-2价变为0价,所以二氧化硫是氧化剂、硫化氢是还原剂,氧化剂被还原、还原剂被氧化,以此来解答;
(2)①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4价降低到+2价,Cl元素的化合价由-1价升高到0价,结合氧化还原反应的电子转移知识分析;
②向FeCl2溶液中通入Cl2生成FeCl3,铁元素的化合价升高,该反应中转移2e-,以此来解答.
解答 解:(1)①氯酸钾分解生成KCl和氧气,其反应的方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,该反应中Cl元素化合价由+5价变为0价,O元素化合价由-2价变为0价,转移的电子数目为: ;故答案为:
;故答案为: ;
;
②该反应中S元素化合价由+4价变为0价、S元素化合价由-2价变为0价,所以二氧化硫是氧化剂,反应中被还原、硫化氢是还原剂反应中被氧化,反应中转移4个电子,则双线桥法标出该反应中电子转移的方向和数目为 ;
;
故答案为: ;
;
(2)①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,氧化剂为MnO2,MnCl2为还原产物,Cl元素的化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,则1mol氧化剂反应转移2mol2e-,改写成离子方程式以及用双线桥法表示反应中电子转移的数目为: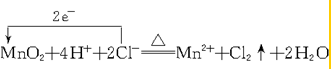 ,故答案为:
,故答案为: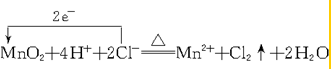 ;
;
②向FeCl2溶液中通入Cl2生成FeCl3,铁元素的化合价升高,该反应中转移2e-,则用单线桥标明电子转移的方向和数目: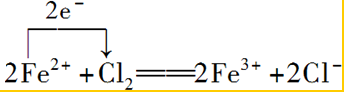 ;
;
故答案为: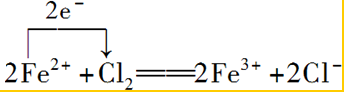 .
.
点评 本题考查氧化还原反应,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 乙酸和水、甲苯和水、己烷和水 |
Ⅰ.含碘废液中I-含量的测定
用移液管量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2mol•L-1 H2SO4溶液和10mL 20% NH4Fe(SO4)2•12H2O溶液,摇匀,小火加热蒸发至碘完全挥发,取下锥形瓶冷却后,加入10mL 2mol•L-1 H2SO4溶液,加入几滴二苯胺磺酸钠(用作指示剂),用0.025 0mol•L-1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录见下表:(已知反应:
①2Fe3++2I-═2Fe2++I2 ②6Fe2++Cr2O${\;}_{7}^{2-}$+14H+═6Fe3++2Cr3++7H2O)
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.60 | 19.65 | 19.55 |
取250mL含碘废液于烧杯中,加入Na2S2O3溶液,并将饱和CuSO4溶液在不断搅拌下滴加到废液中,加热至70℃左右完全反应生成CuI沉淀.过滤,得到的CuI沉淀按图1进行操作,检查装置的气密性后,从分液漏斗中逐滴加浓硝酸(注意滴液的速度),完全反应后,通过减压过滤,得到粗碘固体产品和抽滤液,然后按图2进行粗碘的提纯.
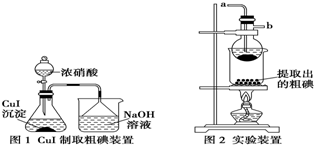
请回答下列问题:
(1)简述图2实验装置中烧瓶的作用升华分离冷凝回收碘.
(2)某同学欲配制200mL 2mol•L-1的H2SO4,配制方法合理的是C.
A.在200mL 1mol•L-1的H2SO4中加入22.4L标准状况下的SO3
B.向100mL 4mol•L-1的H2SO4中加入100mL水
C.取5mol•L-1的H2SO4 80.0mL,加水至200mL
D.将16g NaOH固体加入到200mL 3mol•L-1的H2SO4溶液中
(3)在盛有废液的锥形瓶中先加入5mL 2mol•L-1H2SO4的目的是加热蒸发碘时可有效抑制Fe3+水解,使后续测定结果更准确.
(4)根据滴定的有关数据,计算该废液中I-的含量为14.94g•L-1(保留小数点后两位).
(5)写出图1锥形瓶中发生反应的化学方程式:2CuI+8HNO3=2Cu(NO3)2+NO2↑+I2+4H2O.
(6)按图2装置进行粗碘提纯,采用的分离方法是升华,a、b为冷凝水进出口,其中a(填“a”或“b”)接水龙头,最终能得到较多较高纯度的单质碘.
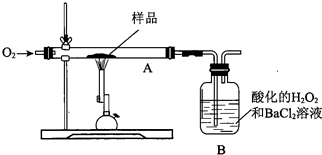
| A. | 测B中沉淀质量 | B. | 测锻烧后A中固体的质量 | ||
| C. | 测B吸收瓶反应前的质量 | D. | 将W蒸干、灼烧,测所得固体质量 |
| A. |  2-甲基丙醇 2-甲基丙醇 | B. |  邻甲基苯酚 邻甲基苯酚 | ||
| C. | CH3CH2OOCCH3 丙酸甲酯 | D. |  2-甲基丙酸 2-甲基丙酸 |
| A. | 1mol铜片与含2molH2SO4的浓硫酸共热 | |
| B. | 1molMnO2粉末与含2molH2O2的溶液共热 | |
| C. | 常温下1mol铝片投入足量的浓硫酸中 | |
| D. | 常温下1mol铜片投入含4molHNO3的浓硝酸中 |
| A. | 锡靑铜的熔点比纯铜低 | |
| B. | 锡靑铜文物在潮湿环镜中的腐蚀比干燥环境中快 | |
| C. | 黄铜(铜锌合金}制作的铜锣不易产生铜绿 | |
| D. | 金属的电化学腐蚀必須在酸性条件下进行 |
 ,它是极性(填“极性”或“非极性”)键形成的非极性分子.
,它是极性(填“极性”或“非极性”)键形成的非极性分子.