题目内容
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、在常温常压下,11.2 L Cl2含有的分子数约为0.5 NA |
| C、25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氦气是单原子分子;
B、不是标准状况下,无法计算氯气的物质的量;
C.注意设置条件的干扰;
D.标况下,水是液体,无法计算其物质的量.
B、不是标准状况下,无法计算氯气的物质的量;
C.注意设置条件的干扰;
D.标况下,水是液体,无法计算其物质的量.
解答:
解:A.含有NA个氦原子的氦气在标准状况下的物质的量是1mol,体积约为22.4L,故A错误;
B.不是标准状况下,无法计算氯气的物质的量,故B错误;
C.64g二氧化硫的物质的量是1mol,含有3mol原子,含有的原子数为3NA,故C正确;
D.标准状况下,水不是气体,无法计算其物质的量,故D错误;
故选C.
B.不是标准状况下,无法计算氯气的物质的量,故B错误;
C.64g二氧化硫的物质的量是1mol,含有3mol原子,含有的原子数为3NA,故C正确;
D.标准状况下,水不是气体,无法计算其物质的量,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
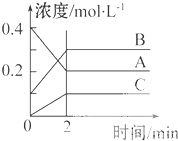 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A、发生的反应可表示为:2A(g)?2B(g)+C(g) |
| B、前2 min A的分解速率为0.1mol?L-1?min-1 |
| C、开始时,正逆反应同时开始 |
| D、2 min时,A、B、C的浓度之比为2:3:1 |
银锌电池广泛用作各种电子仪器的电源,其充电和放电过程可以表示为:Ag2O+Zn+H2O
2Ag+Zn(OH)2,电池放电时,负极上发生反应的物质及电池充电时阴极发生反应的物质分别是( )
| 充电 |
| 放电 |
| A、Zn、Zn(OH)2 |
| B、Ag、Ag2O |
| C、Ag2O、Zn |
| D、Zn(OH)2、Ag2O |
在一定条件下,向2L密闭容器中充入3mol X气体和1mol Y气体,发生下列反应:2X(g)+Y(g)?3Z(g)+2W(g),在某一时刻达到化学平衡时,测出的下列各生成物的物质的量的数据肯定错误的是( )
| A、n(Z)=1.5 mol |
| B、n(Z)=2.4 mol |
| C、n(W)=1.6 mol |
| D、n(W)=2.0 mol |
下列说法不正确的是( )
| A、增大反应物浓度,可增大单位体积内活化分子总数,从而使有效碰撞次数增大 |
| B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
| C、升高温度能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数 |
| D、催化剂能增大单位体积内活化分子的百分数,从而成千成万倍地增大反应速率 |
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )


| A、1 mol A最多能与4 mol H2发生加成反应 |
| B、有机物A可以在一定条件下与HBr发生反应 |
| C、有机物A与浓硫酸混合加热,可以发生消去反应 |
| D、1 mol A与足量的NaOH溶液反应,最多可以消耗 2 mol NaOH |