题目内容
下列说法不正确的是( )
| A、增大反应物浓度,可增大单位体积内活化分子总数,从而使有效碰撞次数增大 |
| B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
| C、升高温度能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数 |
| D、催化剂能增大单位体积内活化分子的百分数,从而成千成万倍地增大反应速率 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:增大浓度、压强,活化分子的浓度增大,但百分数不变,升高温度、加入催化剂,可增大活化分子的百分数,以此解答该题.
解答:
解:A.增大浓度,单位体积活化分子数目增多,则使有效碰撞次数增大,反应速率加快,故A正确;
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的浓度增大,但百分数不变,故B错误;
C.升高温度,活化分子的百分数,反应速率增大,故C正确;
D.催化剂,降低反应所需的活化能,增大单位体积内活化分子的百分数,故D正确.
故选B.
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的浓度增大,但百分数不变,故B错误;
C.升高温度,活化分子的百分数,反应速率增大,故C正确;
D.催化剂,降低反应所需的活化能,增大单位体积内活化分子的百分数,故D正确.
故选B.
点评:本题考查影响反应速率的因素,为高频考点,把握浓度、温度、压强、催化剂对反应速率的影响即可解答,侧重活化理论的理解及分析的考查,题目难度不大.

练习册系列答案
相关题目
下列与化学反应能量变化相关的叙述正确的是( )
| A、2CH3CH2OH(l)+6O2(g)═4CO2(g)+6H2O(l)△H=-1367 kJ/mol,可见乙醇燃烧热△H=-1367 kJ/mol |
| B、放热反应的反应速率总是大于吸热反应的反应速率 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
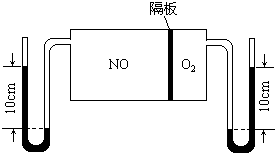
用下列实验装置进行相应的实验,能达到实验目的是( )
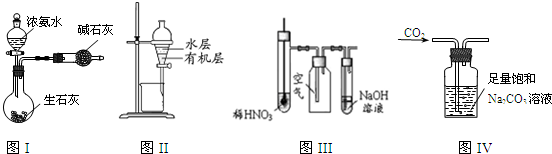

| A、图I所示装置制取干燥的氨气 |
| B、图Ⅱ所示装置用于提取I2的CCl4溶液中的I2 |
| C、图Ⅲ所示装置微热稀HNO3,在广口瓶中可收集NO气体 |
| D、图IV所示装置可用于除去CO2中含有的少量HCl |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、在常温常压下,11.2 L Cl2含有的分子数约为0.5 NA |
| C、25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
下列化学用语正确的是( )
A、水的电子式: |
B、氯化钠的电子式: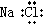 |
| C、KClO3的电离方程式:KClO3=K++Cl-+3O2- |
| D、碳酸氢钠的电离方程式:NaHCO3=Na++HCO3- |